
下列有关元素的性质及其递变规律正确的是
A.同周期金属元素的化合价越高,其原子失电子能力越强
B.第二周期元素从左到右,最高正价从+1递增到+7
C.同主族元素的简单阴离子还原性越强,则该元素对应的气态氢化物稳定性越强
D.IA族与VIIA族元素间可形成共价化合物或离子化合物
科目:高中化学 来源: 题型:
一未配平的离子方程式为______+XO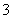 +6H+===3X2+3H2O,据此判断,氧化产物和还原产物的物质的量之比为 ( )
+6H+===3X2+3H2O,据此判断,氧化产物和还原产物的物质的量之比为 ( )
A.1∶1 B.3∶1 C.5∶1 D.7∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
水是地球表面上普遍存在的化合物,我们可以用我们学习的物质结构与性质的有关知识去认识它。
(1)水的组成元素为氢和氧。氧的基态原子的价电子排布图为______________,氧的第一电离能在同周期元素中由大到小排第______位。
(2)根据杂化轨道理论,水分子中的氧原子采取的杂化形式是_______;根据价层电子对互斥理论,水分子的VSEPR模型名称为______________;根据等电子体原理,写出水合氢离子的一个等电子体(写结构式)_____________。
(3)水分子可以形成许多水合物。
①水分子可以作配体和铜离子形成水合铜离子[Cu(H2O)4]2+,1mol水合铜离子中含有σ键数目为_________。
②图1是水合盐酸晶体H5O2+·Cl-中H5O2+离子的结构。
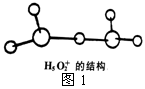
在该离子中,存在的作用力有______________。
a.配位键 b.极性键 c.非极性键 d.离子键
e.金属键 f.氢键 g.范德华力 h.π键 i.σ键
(4)韩国首尔大学科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成了“暖冰”。请从结构上解释生成暖冰的原因_________________________________。
(5)最新研究发现,水能凝结成13种类型的结晶体,除普通冰以外其余各自的冰都有自己奇特的性质:有在-30℃才凝固的超低温冰,它的坚硬程度可和钢相媲美,能抵挡炮弹轰击;有在180℃高温下依然不变的热冰;还有的冰密度比水大,号称重冰。图2为冰的一种骨架形式,依此为单位向空间延伸。
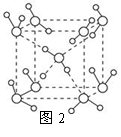
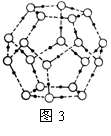
①该冰中的每个水分子有_________个氢键;
②冰融化后,在液态水中,水分子之间仍保留有大量氢键将水分子联系在一起,分子间除了无规则的分布及冰结构碎片以外,一般认为还会有大量呈动态平衡的、不完整的多面体的连接方式。右图的五角十二面体是冰熔化形成的理想多面体结构。假设图3中的冰熔化后的液态水全部形成右图的五角十二面体,且该多面体之间无氢键,则该冰熔化过程中氢键被破坏的百分比为________。
③如果不考虑晶体和键的类型,哪一物质的空间连接方式与这种冰连接类似?____________;
④已知O-H…O距离为295pm,列式计算此种冰晶体的密度 g/cm3。(已知2952=8.70×104,2953=2.57×107,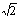 =1.41,
=1.41,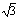 =1.73)
=1.73)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知短周期元素的离子:aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是
A.原子半径 A>B>D>C B.原子序数 d>c>b>a
C.离子半径 C>D>B>A D.单质的还原性 A>B>D>C
查看答案和解析>>
科目:高中化学 来源: 题型:
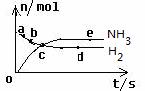
合成氨工业对国民经济和社会发展具有重要意义。对于密闭容器中的 N2(g)+3H2(g) 2NH3(g),在673K 30MPa下,n(NH3)
2NH3(g),在673K 30MPa下,n(NH3)
和n(H2)随时间变化的关系如右图所示。下列叙述正确的是
A.a点的正反应速率比b点的小
B.d点和e点n(N2)不相等
C.c点反应达平衡
D. d点的正反应速率与e点正反应速率相等
 |
查看答案和解析>>
科目:高中化学 来源: 题型:
20.A、B、C、D四种短周期元素,A、B为同周期元素,B、C同主族,B、C可形成共价化合物BC3 和BC2,A、D同主族,A的原子结构示意图如下图,据此填空:
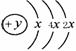 (1)A的元素名称为 。
(1)A的元素名称为 。
(2)A、B、C三种元素的原子,半径由小到大的顺序为 (用元素符号作答)。
(3)A、B和D最高价氧化物对应的水化物,酸性由强到弱的顺序为 (用对应酸的分子式作答,下同)。若用下图装置验证这三种酸的酸性强弱,则在装置中加入的试剂分别为:Ⅰ ,Ⅱ ,Ⅲ 。
观察到的实验现象为 。
写出Ⅲ中现象对应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
臭氧能吸收有害紫外线,保护人类赖以生存的空间。O3分子的结构如图,实线表示σ键,另外中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键(虚线内部)——三个O原子均等地享有这4个电子。根据等电子体原理,下列分子中与O3分子的结构最相似的是( )
A.SO2 B.CO2 C.H2O D.BeCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
工业废水中含有多种有害成分,任意排放将造成严重污染,进行分类处理达标后才能排放。
(1)含有Cu2+等离子的废水,常加入FeS等难溶物质作为沉淀剂除去。请用离子方程式说明上述除杂的原理 。实验室可利用FeS制取H2S,若将H2S通入足量NaOH溶液中,所得溶液中Na+与其他微粒的浓度关系是c(Na+)= 。
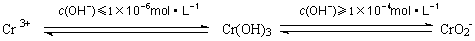 (2)含铬废水有毒,危害很大.处理方法是在含+6价铬的废水中加入一定量的硫酸和硫酸亚铁,使+6价铬还原成+3价铬;再调节溶液pH在6~8之间,使Fe3+和Cr3+转化为Fe(OH)3、Cr(OH)3沉淀而除去.用离子方程式表示溶液pH不能超过10的原因 。
(2)含铬废水有毒,危害很大.处理方法是在含+6价铬的废水中加入一定量的硫酸和硫酸亚铁,使+6价铬还原成+3价铬;再调节溶液pH在6~8之间,使Fe3+和Cr3+转化为Fe(OH)3、Cr(OH)3沉淀而除去.用离子方程式表示溶液pH不能超过10的原因 。
已知:
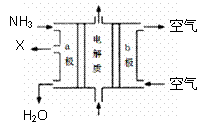 (3)废水中的氨可以回收再利用。
(3)废水中的氨可以回收再利用。
①氨能设计成如图所示的碱性燃料电池。产生的X气体可直接排放到大气中。a电极作 极,其电极反应式为
。
②加水稀释氨水的过程中,下列表达式的数值变大的是 。
A.c(H+) B.c(OH-)/c(NH3·H2O)
C.c(H+)·c(OH-) D.c(NH4+) +c(H+)
③T℃下, NH3·H2O的电离常数为Ka,NH4+的水解平衡常数为Kh,则该温度下水的离子积常数Kw= 。
④一定条件下,向某密闭容器中加入一定量的N2和H2发生可逆反应:
N2(g)+3H2(g) 2NH3(g)ΔH=-92.2 kJ·mol-1,测得0到10 s内,c(H2)减小了0.75 mol·L-1,下列说法正确的是( )
2NH3(g)ΔH=-92.2 kJ·mol-1,测得0到10 s内,c(H2)减小了0.75 mol·L-1,下列说法正确的是( )
A.该反应的逆反应的活化能不小于92.2 kJ·mol-1
B.10 s内氨气的平均反应速率为0.025 mol·L-1·s-1
C.10 s到15 s内c(NH3)增加量小于0.25 mol·L-1
D.达平衡后,分离出少量NH3,平衡向正反应方向移动,v正增大
查看答案和解析>>
科目:高中化学 来源: 题型:
某无色透明溶液与铝反应放出氢气,该溶液中可能含有Mg2+、Cu2+、Ba2+、H+、Ag+、SO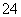 、SO
、SO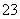 、HCO
、HCO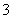 、OH-、NO
、OH-、NO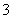 十种离子中的若干种,下列推断正确的是 ( )
十种离子中的若干种,下列推断正确的是 ( )
A.当溶液中有Al3+生成时,溶液中可能存在:SO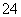 、NO
、NO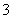 、H+、Mg2+
、H+、Mg2+
B.当溶液中有Al3+生成时,溶液中一定存在:H+、SO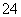 ;可能存在Mg2+
;可能存在Mg2+
C.当溶液中有[Al(OH)4]-生成时,溶液中一定存在:OH-、Ba2+、NO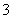
D.当溶液中有[Al(OH)4]-生成时,溶液中可能存在:OH-、Ba2+、NO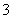 、SO
、SO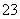
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com