
| A. | 4mol | B. | 3mol | C. | 2mol | D. | 1mol |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2是硫及某些含硫化合物在空气中燃烧的产物 | |
| B. | SO2具有漂白性,可以使品红溶液褪色 | |
| C. | SO2溶于水后生成H2SO4 | |
| D. | SO2是一种大气污染物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
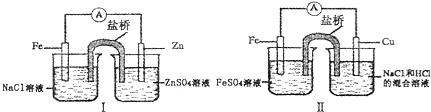
| A. | 装置I和装置II中负极反应均是Fe-2e-═Fe2+ | |
| B. | 装置I和装置II中正极反应均是O2+4e-+2H2O-═4OH- | |
| C. | 装置I和装置II中盐桥中的阳离子均向右侧烧杯移动 | |
| D. | 装置I和装置II中正极均被保护 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 成分 | 质量(g) | 摩尔质量(g•mol-1) |
| 蔗糖 | 25.00 | 342 |
| 硫酸钾 | 0.25 | 174 |
| 阿司匹林(C9H8O4) | 0.17 | 180 |
| 高锰酸钾 | 0.25 | 158 |
| 硝酸银 | 0.02 | 170 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
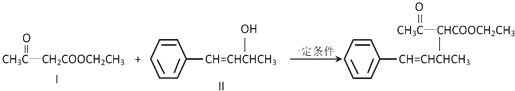
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
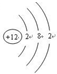 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间里消耗n molA2,同时生成2n molAB | |
| B. | 容器中的总压强不随时间而变化 | |
| C. | A2、B2、AB的物质的量之比满足1:2:3 | |
| D. | 单位时间里生成2n molAB的同时生成n molB2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com