
| A.氯化钙受热挥发 | B.氯化钙受热分解 |
| C.钙离子中电子跃迁 | D.氯离子中电子跃迁 |




 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源:不详 题型:单选题
| A.NaOH、H2SO4、(NH4)2SO4 | B.MgO、Na2SO4、NH4HCO3 |
| C.Na2O2、KOH、Na2SO4 | D.HCl、Al2O3、MgCl2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
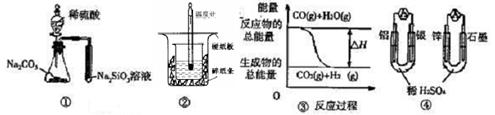
| A.用图 ① 所示实验可比较硫、碳、硅三种元素的非金属性强弱 |
| B.用图 ② 所示实验装置可以测定中和热 |
C.图 ③ 表示反应“CO(g)+H2O(g) CO2(g)+H2(g)”为将热能转化为化学能 CO2(g)+H2(g)”为将热能转化为化学能 |
| D.图 ④ 两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.PCl3中P原子sp3杂化,为三角锥形 | B.BCl3中B原子sp2杂化,为平面三角形 |
| C.CS2中C原子sp杂化,为直线形 | D.H2S分子中,S为sp杂化,为直线形 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;反应②CO(g)+1/2O2(g)===CO2(g) ΔH=b kJ·mol-1;测得在不同温度下,K值如下:
FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;反应②CO(g)+1/2O2(g)===CO2(g) ΔH=b kJ·mol-1;测得在不同温度下,K值如下:| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2. 40 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com