
(16分)铜及其化合物在生产和生活实际中应用广泛。
Ⅰ.某学习小组对粗铜提纯(电解精炼)后的阳极泥(主要成分为银、金)进行如下实验。
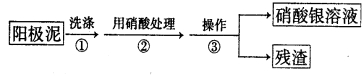
(1)操作③所需的仪器有:烧杯、 。
(2)稀硝酸处理阳极泥得到硝酸银稀溶液,写出该步反应的化学方程式_____ _。
(3)为了回收金,他们查阅了有关资料如下表:
编号 | 常温下反应 | 化学平衡常数 |
反应1 | Au + 6HNO3 | <10?5 |
反应2 | Au3+ + Cl? | >105 |
从资料中可知,常温下金很难与硝酸反应,但却可溶于王水(浓硝酸与浓盐酸体积比为1∶3的混合物)。请你运用化学平衡移动原理,简要说明金能溶于王水的原因: 。
Ⅱ.实验室用铜制备CuSO4溶液有多种方案,某实验小组给出了以下三种方案:
请回答有关问题:

(4)甲方案:将6.4g铜丝放到90 mL 1.5 mol·L-1的稀硫酸中,控温在50℃。加入40 mL 10%的H2O2,反应0.5小时,升温到60℃,持续反应1小时后,经一系列操作,得CuSO4·5H2O 20.0 g【已知有关摩尔质量:M(Cu)=64 g/mol, M(CuSO4·5H2O) =250 g/mol】。
①反应时温度控制在50℃~60℃,不宜过高的原因是 ;
②本实验CuSO4·5H2O的产率为 。
(5)乙方案:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加物质A调节pH至4 ,然后过滤、浓缩、结晶。
①物质A可选用以下的 (填序号);
A.CaO B.NaOH C.CuCO3 D.Cu2(OH)2CO3 E.Fe2(SO4)3
②反应中加入少量FeSO4可加速铜的氧化,FeSO4的作用是 ;
(6)丙方案:为了节约原料,硫酸和硝酸的物质的量之比最佳为,n(H2SO4):n(HNO3)= 。
Ⅰ.(1)漏斗、玻璃棒;(2分) (2)3Ag +4HNO3(稀)=3AgNO3+NO↑+2H2O(2分)
(3)浓盐酸含有大量Cl-,Au3+与Cl-形成稳定的AuCl4-离子,使反应②平衡向右移动,使金溶于王水中;(2分)
Ⅱ.(4)①双氧水受热易分解造成损耗(2分); ②80%(3分)
(5)①CD(2分); ②作催化剂(或起催化作用)(2分) (6)3:2(2分)
【解析】
试题分析:Ⅰ.(1)过滤所需的玻璃仪器有:烧杯、漏斗、玻璃棒,故答案为:漏斗、玻璃棒;
(2)稀硝酸的还原产物是NO,所以银与稀硝酸反应的离子方程式为3Ag +4HNO3(稀)=3AgNO3+NO↑+2H2O;
(3)根据表中的信息,Au+6HNO3(浓)=Au(NO3)3+3NO2↑+3H2O,并且Au3++4Cl-=AuCl4-,在王水中,含有浓硝酸和浓盐酸,浓盐酸含有大量氯离子,Au3+离子与氯离子形成稳定的AuCl4-离子,使反应2平衡向右移动,则金溶于王水中;
Ⅱ.(4)①由于双氧水受热易分解生成氧气和水,因此温度不易过高的原因是双氧水受热易分解造成损耗;
②6.4g铜的物质的量是0.1mol,理论上应该生成胆矾0.1mol,其质量是0.1mol×250g/mol=25g,为实际生产了20g,所以产率是 ×100%=80%;
×100%=80%;
(5)①加入A物质的目的是除去亚铁离子,由于不能引入杂质,因此氧化钙、氢氧化钠和硫酸铁均不能选择,答案选CD;
②硫酸亚铁易被氧气氧化生成硫酸铁,而硫酸铁能溶解铜生成硫酸铜和硫酸亚铁,所以硫酸亚铁的作用是作催化剂(或起催化作用);
(6)要节约原料,则硝酸应该全部被还原为NO,则根据方程式3Cu+8H++2NO3-=Cu2++4H2O+2NO↑。其中硝酸是一元酸,硫酸是二元酸,则要提供8mol氢离子,则消耗硝酸2mol,硫酸是3mol,即n(H2SO4):n(HNO3)=3:2。
考点:考查化学实验基本操作、外界条件对平衡状态的影响、硫酸铜制备的有关判断与计算


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、晶体硅是高科技的支柱材料,可用于制备太阳能电池板和光导纤维 | B、用浸泡过高锰酸钾溶液的硅藻土吸收水果产生的乙烯可以延长水果的保存期 | C、绿色化学的核心是利用化学原理对环境污染进行治理 | D、明矾常用作净水剂,目的是除去水中的悬浮杂质和有害细菌 |
查看答案和解析>>
科目:高中化学 来源:2015届广东省海珠等四区高三联考理综化学试卷(解析版) 题型:实验题
(18分)铁是广泛应用的金属。
(1)铁元素在周期表中的位置是 ,工业上通常采用高炉炼铁的方法制得单质铁,请写出用赤铁矿与CO反应炼铁的化学方程式 。
(2)请补充完成实验室制备Fe(OH)3胶体的操作步骤:
①取25ml蒸馏水加热至沸腾
②
③继续煮沸至
④停止加热。
(3)几种离子生成氢氧化物沉淀的pH如下表(已知Fe(OH)2呈絮状,不易从溶液中除去)
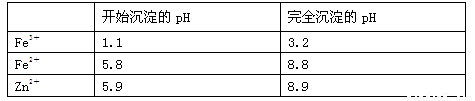
注:开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算现有某溶液含有Fe2+、Fe3+、Zn2+、SO42-,要使溶液中的Fe2+和Fe3+完全沉淀,需往溶液中先加入H2O2,作用是 ,然后再加入NH4HCO3调节pH至 ,NH4HCO3中起调节pH作用的离子是 (填离子符号)
①设计实验探究铁钉和钢钉在碱性溶液中遇到高锰酸钾时是否能发生电化学腐蚀。实验如下
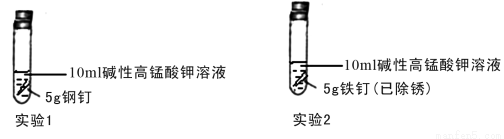
①完成下列表格
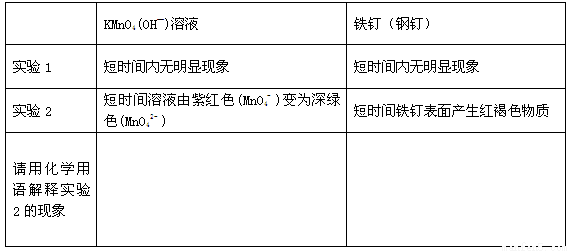
②实验2比实验1能够较快看到以上现象的原因是 。
查看答案和解析>>
科目:高中化学 来源:2015届广东省海珠等四区高三联考理综化学试卷(解析版) 题型:选择题
下列表述正确的是
A.氧化铁是一种碱性氧化物,常用作红色油漆和涂料
B.在医疗上碳酸钠、氢氧化铝均可用于治疗胃酸过多
C.Na2O2与水反应,红热的Fe与水蒸气反应均能生成碱
D.人造刚玉熔点很高,可用作高级耐火材料,主要成分是SiO2
查看答案和解析>>
科目:高中化学 来源:2015届广东省揭阳市高三上学期第一次阶段考试理综试卷(解析版) 题型:选择题
几种短周期元素的原子半径及主要化合价如下表:
元素代号 | X | Y | Z | M | N | R | Q | |
原子半径(×10-10 m) | 1.86 | 0.99 | 1.43 | 1.60 | 1.02 | 0.75 | 0.74 | |
主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +6 | +5 | —— |
最低负价 | —— | -1 | —— | —— | -2 | -3 | -2 | |
下列说法正确的是
A.气态氢化物的稳定性:N > Y
B.M(OH)2的碱性比XOH的碱性强
C.元素X和Q形成的化合物中可能含有共价键
D.X、Z、R的最高价氧化物对应的水化物之间可两两相互反应
查看答案和解析>>
科目:高中化学 来源:2015届广东省惠州市高三第二次调研考试化学试卷(解析版) 题型:实验题
(16分) Na2S2O3可用作照相的定影剂等。已知Na2S2O3的某些性质如下:
(1) S2O32-能被I2氧化为S4O62-;(2) 酸性条件下S2O32-迅速分解为S和SO2
Ⅰ. 市售Na2S2O3中常含有SO42-, 请完成以下方案,检验其中含有的SO42-:
实验步骤 | 预期现象或结论 |
步骤1:取少量固体样品溶于无氧蒸馏水中 | 固体完全溶解得无色澄清溶液 |
步骤2: |
|
步骤3: |
|
Ⅱ. 利用K2Cr2O7标准溶液可以定量测定市售硫代硫酸钠试剂的纯度,步骤为:
① 溶液配制:称取1.0g Na2S2O3试样,用新煮沸并冷却的蒸馏水溶解,最终定容至100mL。
② 滴定:取10.00mL0.01mol·L-1K2Cr2O7标准溶液,加硫酸酸化,再加过量KI溶液。
③ 往步骤②所得溶液加入某指示剂,用Na2S2O3滴定至终点(2S2O32- +I2=S4O62- +2I-),记录Na2S2O3溶液用量,平行滴定3次。
(1)步骤①中必须使用的玻璃仪器有烧杯、玻璃棒、 和 。
(2)完成并配平步骤②中的离子反应: Cr2O72-+ ( )+ I- == I2 + Cr3++ H2O。
(3)步骤③中,指示剂最好选用 ,该滴定应在接近中性的溶液中进行而不在强酸性溶液进行的原因是 。
(4)若3次滴定Na2S2O3溶液的平均用量为12.00mL,则样品的纯度为 。(Na2S2O3的摩尔质量为158g·mol-1)。
查看答案和解析>>
科目:高中化学 来源:2015届广东省广州市高三9月第二次月考化学试卷(解析版) 题型:选择题
对于常温下0.1 mol·L-1氨水和0.1 mol·L-1醋酸,下列说法正确的是
A.0.1 mol·L-1氨水,溶液的pH<13
B.0.1 mol·L-1氨水加水稀释,溶液中c(H+)和c(OH-)都减小
C.0.1 mol·L-1醋酸溶液中:c(H+)=c(CH3COO-)
D.0.1 mol·L-1醋酸与0.1 mol·L-1NaOH溶液等体积混合所得溶液中:
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2015届广东省佛山市高三10月月考化学试卷(解析版) 题型:选择题
下列关于钠及其氧化物的叙述中,正确的是
A.金属钠的硬度较大,密度较小,能浮在水面上
B.Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物
C.钠易与空气中的水、氧气等物质反应,所以通常将它保存在煤油里
D.钠是银白色金属,放置在空气中表面变暗是由于生成了过氧化钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com