
硼元素在化学中有很重要的地位。硼的化合物在农业、医药等方面用途很广。请回答下列问题:
(1)写出与B元素同主族的Ga元素的基态原子核外电子排布式 。
从原子结构的角度分析,B、N、O元素的第一电离能由大到小的顺序为 。
(2)立方氮化硼可利用人工方法在高温高压条件下合成,属于超硬材料。同属原子晶体的氮化硼(BN)比晶体硅具有更高硬度和耐热性的原因是 。
(3)在BF3分子中中心原子的杂化轨道类型是 ,SiF4粒子的空间构型是 。又知若有d轨道参与杂化,能大大提高中心原子成键能力。试解释为什么BF3、SiF4水解的产物中,除了相应的酸外,前者生成BF后者却是生成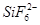 : 。
: 。
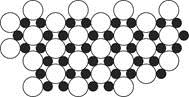
(4)科学家发现硼化镁在39 K时呈超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列。下图是该晶体微观空间中取出的部分原子沿z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上。根据图示确定硼化镁的化学式为 。
(1)1s22s22p63s23p63d104s24p1 N>O>B
(2)B—N键长比Si—Si短(或B—N键能较大)
(3)sp2杂化 正四面体 B原子最外电子层为L层,无d轨道;而Si原子最外层为M层,有d轨道,可参与杂化,使Si配位数增加至6
(4)MgB2
【解析】(1)氮元素的2p轨道为半充满状态,较稳定,所以第一电离能比氧元素的大。(2)原子晶体中,共价键键长越短,键能越大,则硬度和耐热性越强。(3)中心原子杂化轨道数=σ键个数+孤电子对数,BF3分子的中心原子含有3个σ 键,没有孤电子对,杂化轨道数为3,采取sp2杂化;SiF4分子的中心原子含有4个σ 键,没有孤电子对,杂化轨道数为4,采取sp3杂化,空间构型为正四面体形;Si原子最外电子层含有d轨道,而B原子最外电子层不含d轨道。(4)由图可知,硼化镁晶体的晶胞结构为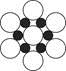 ,其中边缘上的Mg原子属于三个晶胞所有,故一个晶胞中含有3个Mg原子和6个B原子,则晶体中Mg原子和B原子个数比为1∶2。
,其中边缘上的Mg原子属于三个晶胞所有,故一个晶胞中含有3个Mg原子和6个B原子,则晶体中Mg原子和B原子个数比为1∶2。


科目:高中化学 来源:2014高考名师推荐化学硅及其化合物主要性质、材料(解析版) 题型:选择题
下列有关物质的性质和应用均正确的是
A.NH3能氧化氮氧化物,可用于汽车尾气净化
B.瓷坩埚能耐高温,可用于加热分解石灰石
C.Fe在O2中的燃烧产物可用于制红色涂料
D.Mg(OH)2分解吸热且生成高熔点固体,可用作阻燃剂
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学电解池的工作原理、电极反应式的书写(解析版) 题型:选择题
高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁做电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是
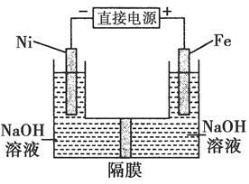
A.铁是阳极,电极反应为Fe-6e-+4H2O=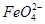 +8H+
+8H+
B.镍电极上的电极反应为2H++2e-=H2↑
C.若隔膜为阴离子交换膜,则OH-自右向左移动
D.电解时阳极区pH降低、阴极区pH升高,最终溶液pH不变
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学环境污染与保护(解析版) 题型:选择题
下列说法符合绿色化学思想的是
A.对工业生产硝酸产生的废气、废水进行严格处理
B.利用根瘤菌固氮以减少氮肥生产厂
C.实验室制备NO2时在通风橱内进行
D.生产硫酸的工厂种草、种树,使其成为“花园式工厂”
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学物质结构与性质推断(解析版) 题型:填空题
下表为周期表的一部分,其中的编号代表对应的元素。

试填空。
(1)写出上表中元素I的基态原子的电子排布式和价层电子排布图: 。
元素C、D、E、F的第一电离能由大到小的顺序是 (用元素符号表示)。
(2)元素A分别与C、D、E形成最简单的常见化合物分子甲、乙和丙。下列有关叙述不正确的有 。
A.甲、乙和丙分子的空间构型分别为正四面体形、三角锥形、V形
B.甲、乙和丙分子中,中心原子均采取sp3的杂化方式
C.三种分子中键角由大到小的顺序是丙>乙>甲
D.甲、乙和丙分子均为由极性键构成的极性分子
(3)由元素J、C、E组成一种化学式为J(CE)5的配位化合物,该物质常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂。据此可判断:
①该化合物的晶体类型为 。
②该化合物的晶体中存在的作用力有 。
A.离子键
B.极性键
C.非极性键
D.范德华力
E.氢键
F.配位键
③根据共价键理论和等电子体理论分析,CE分子中σ键与π键的数目比为 。
(4)在测定A与F形成的化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是 。
(5)某些不同族元素的性质也有一定的相似性,如表中元素G与元素B,原因是 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学物质的量及阿伏伽德罗常数(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列说法一定正确的是
A.25 ℃,pH=13的NaOH溶液中含有OH-为0.1NA
B.1 L 0.1 mol·L-1 CuSO4溶液中含有Cu2+为0.1NA
C.2.24 L N2和NH3混合气体中原子间含有的共用电子对数目为0.3NA
D.2 mol SO2和1 mol O2在一定条件下充分反应后,所得混合气体的分子数大于2NA
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学物质的检验(解析版) 题型:填空题
有一瓶澄清的溶液,其中可能有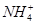 、K+、Na+、Mg2+、Ba2+、Al3+、Cl-、I-、
、K+、Na+、Mg2+、Ba2+、Al3+、Cl-、I-、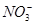 、
、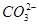 、S2-、
、S2-、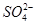 、
、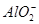 、
、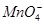 ,取该溶液进行以下实验:
,取该溶液进行以下实验:
(1)取pH试纸检验,溶液呈强酸性,可以排除 离子的存在;
(2)取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡后CCl4层呈紫色,可以排除 离子的存在;
(3)另取出部分溶液逐滴加入NaOH溶液,使溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,溶液均无沉淀产生,则又可以排除 离子的存在;
(4)取出部分上述碱性溶液滴加Na2CO3溶液后,有白色沉淀生成,证明 离子存在,又可排除 离子的存在;
(5)将(3)得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。根据上述实验事实确定:该溶液中肯定存在的离子是 ,还不能确定是否存在的离子是 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学溶度积、沉淀的生成、溶解、转化(解析版) 题型:选择题
下列叙述不正确的是
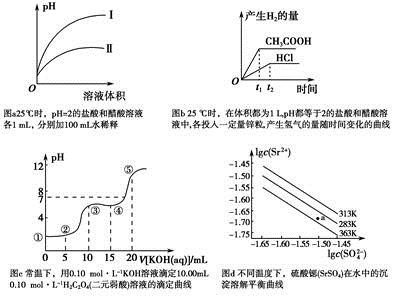
A.图a中,曲线Ⅱ表示醋酸溶液加100 mL水稀释的图像
B.图b中,可能各投入的锌粒颗粒大小相同且质量均为0.65 g
C.图c中,在①、②、③、④、⑤各点的溶液中所含阴离子种类不同
D.图d中,三个不同温度中,313 K时Ksp(SrSO4)最大;且283 K时,图中a点对应的溶液是不饱和溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com