
| A. | Z与Y、Z与W形成的化合物的化学键完全相同 | |
| B. | X与Y组成的简单氢化物的沸点高于X与R组成的简单氢化物的沸点,是因为非金属性Y>R | |
| C. | 简单离子的半径:Z>R>W>Y | |
| D. | Y、Z、W三种元素组成的化合物的水溶液可能显碱性 |
分析 X、Y、Z、R、W是原子序数依次增大的五种短周期元素.Y和R同主族,Y处于第二周期,R处于第三周期,可组成共价化合物RY2,则Y为O元素,R为S元素,RY2为SO2,W的原子序数大于硫元素,故W为Cl元素,Y和Z最外层电子数之和与W的最外层电子数相同,则Z的最外层电子数为7-6=1,处于第ⅠA族,原子序数大于氧元素,故Z为Na元素,25℃时0.1mol•L-1X和W形成化合物的水溶液pH为1,属于强酸,则X为H元素,以此来解答.
解答 解:由上述分析可知,X为H,Y为O,Z为Na,R为S,W为Cl,
A.Z与Y可以形成Na2O、Na2O2,前者含有离子键、后者含有离子键、共价键,而Z与W形成的化合物为NaCl,只含有离子键,故A错误;
B.X与Y组成化合物为H2O、H2O2,X与R组成的化合物H2S,前者分子间存在氢键,沸点高于硫化氢,与非金属性无关,故B错误;
C.Y、Z、R、W的简单离子分别为O2-、Na+、S2-、Cl-、电子层结构相同核电荷数越大离子半径越小、电子层越多离子半径越大,故离子半径:S2->Cl->O2->Na+,故C错误;
D.Y、Z、W三种元素组成的化合物有NaClO等,NaClO溶液中次氯酸根水解,溶液显碱性,故D正确;
故选D.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的位置、元素化合物知识、原子序数来推断元素为解答的关键,侧重分析与应用能力的考查,注意Y、R元素的位置及二者形成的共价化合物RY2”是推断的突破口及氢键对物质性质的影响,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 由反应①知H2的燃烧热为571.6kJ/mol | |
| B. | 反应②中生成物的总能量高于反应物的总能量 | |
| C. | 反应③若改用新催化剂,△H3不变化 | |
| D. | 反应CH4(g)═C(s)+2H2(g)的△H=+74.8kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | a | b | |||||
| 3 | c | d | e | f |
| A. | 元素 a 是制备一种高效电池的重要材料 | |
| B. | 由于分子间氢键的作用,同族中由 b 元素形成的氢化物沸点是最高的 | |
| C. | c、d 两元素的单质构成原电池两电极时,d 可能为负极 | |
| D. | e、f 的含氧酸的酸性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO32-+Ba2+=BaCO3 | |
| B. | HCO3-+OH-→H2O+CO32- | |
| C. | HCO3-+Ba2++OH-→H2O+BaCO3 | |
| D. | 2HCO3-+Ba2++OH-=BaCO3+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铜的化学性质比铁稳定,在铁闸上安装铜块可减慢铁闸的腐蚀速率 | |
| B. | 氢氧燃料电池正极消耗5.6 L气体时,电路中通过的电子数为6.02×1023个 | |
| C. | 若2NO(g)+2CO(g)═N2(g)+2CO2(g)在常温下能自发进行,则该反应的△H<0 | |
| D. | 相同条件下,100 mL pH=3的HA溶液与HB溶液分别与足量的锌反应,HB放出氢气较多,说明HB酸性比HA的弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
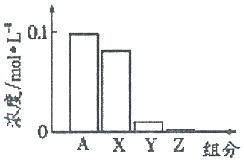 常温下,0.2moI•L-l的Na2CO3溶液与0.2moI•L-l的盐酸等体积混合后,所得溶液中部分微粒组分与浓度的关系如图所示,X、Y、Z均表示含碳微粒,下列说法正确的是( )
常温下,0.2moI•L-l的Na2CO3溶液与0.2moI•L-l的盐酸等体积混合后,所得溶液中部分微粒组分与浓度的关系如图所示,X、Y、Z均表示含碳微粒,下列说法正确的是( )| A. | A代表Na+浓度 | |
| B. | 该溶液中c(OH-)>c(Y) | |
| C. | 向该溶液中加水稀释,所有离子浓度均减小 | |
| D. | 该混合溶液中:c(X)+c(Y)+c(Z)═2c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 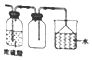 利用图收集干燥的氯化氢气体 | |
| B. | 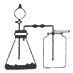 选择合适的试剂,利用图2可分别制取并收集少量CO2、NO和O2 | |
| C. |  利用图可验证铁发生吸氧腐蚀 | |
| D. |  利用图蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
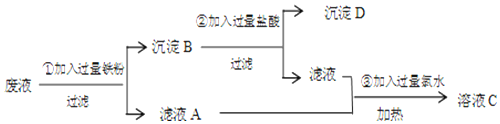
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com