
下列化学用语或模型表示正确的是
A.钠离子的结构示意图:
B.CO2分子的比例模型:
C.乙醇分子的结构简式:CH3CH2OH
D.中子数为2的氢原子符号:12H
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源:2014-2015学年广西玉林市博白县高三下学期返校调研考试化学试卷(解析版) 题型:实验题
(14分)半导体生产中常需要控制掺杂,以保证控制电阻率。三氯化磷(PCl3)是一种重要的掺杂剂。实验室要用黄磷(即白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如下图所示:(部分夹持装置略去)
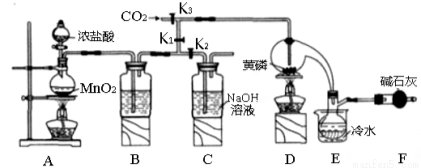
已知黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5 PCl3遇水会强烈水解生成 H3PO3和HC1。遇O2会生成POCl3,POCl3溶于PCl3,PCl3、POCl3的熔沸点见下表:
物质 | 熔点/℃ | 沸点/℃ |
PCl3 | -112 | 75.5 |
POCl3 | 2 | 105.3 |
请回答下列问题:
(1)A装置中制氯气的离子方程式为 。
(2)B中所装试剂是 ,
E中冷水的作用是 ,
F中碱石灰的作用是____ 。_
(3)实验时,检査装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷。通干燥CO2的作用是 。
(4)粗产品中常含有POCl3、PCl5等。加入黄磷加热除去PCl5后.通过_____(填实验操作名称),即可得到较纯净的PCl3。
(5)通过下面方法可测定产品中PCl3的质量分数
①迅速称取1.00 g产品,加水反应后配成250 mL溶液;
②取以上溶液25.00 mL,向其中加入10.00 mL 0.1000 mol·L-1碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000 mol·L-1的Na2S2O3,溶液滴定②重复②、③操作,平均消耗Na2S2O3,溶液8.40 mL
已知:H3PO3+H2O+I2 =H3PO4+2HI,I2+2Na2S2O3 = 2NaI+Na2S4O6,假设测定过程中没有其他反应。根据上述数据,该产品中PC13的质量分数为_______。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省、广雅中学、佛山一中高三联考理综化学试卷(解析版) 题型:实验题
(16分)过氧化钙在常温下是无色或淡黄色粉末,易溶于酸,难溶于水、乙醇等溶剂,常用于种子消毒、药物制造、鱼池增氧等。
I.某实验小组在实验室用钙盐制取CaO2·8H2O(该反应为放热反应)

(1)A为实验室制取氨气的装置,则A中试管所装的试剂的名称为 。
(2)仪器B的作用是 。
(3)写出生成CaO2·8H2O的离子方程式 。
(4)制取CaO2·8H2O一般在0~5℃的低温下进行,原因是 。
II.该实验小组欲通过测量气体的体积来探究CaO2与SO2反应的特点。装置如下图:
(硬质玻璃管中为无水CaO2)

【提出假设】
假设1:反应只发生2SO2+2CaO2=2CaSO3+O2,SO2未被氧化;
假设2:反应只发生SO2+CaO2=CaSO4,SO2完全被氧化;
假设3:上述两个反应均发生,SO2部分被氧化。
【实验探究】
(5)该实验装置有一处明显错误,请改正 。
(6)试剂A为浓硫酸,试剂B的作用是 。
【实验数据处理】实验测得装置C中过氧化钙质量增加了m1 g,装置D质量增加了m2 g,
装置E中收集到的气体为V L(已换算成标准状况下)。
(7)在记录量筒中的液面位置时,除视线平视外,还应 。
(8)如果假设3成立,则V的取值范围是 【M(CaO2)=72,M(CaSO3)=120】。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省莆田市高三质量检测化学试卷(解析版) 题型:选择题
利用下图所示装置(电极均为惰性电极)可吸收SO2,并制取硫酸和烧碱溶液,下列说法正确的是
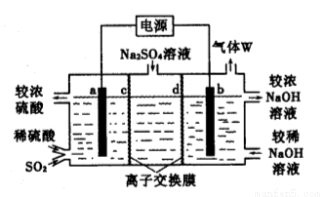
A.a电极反应式:SO2 + 2H2O - 2e- == SO42- + 4H+
B.b极与电源的正极相连
C.离子交换膜c为阳离子交换膜
D.气体W为氧气
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省莆田市高三质量检测化学试卷(解析版) 题型:选择题
甲、乙、丙、丁四种物质中,均含有相同的某种元素。在一定条件下它们之间存在如下转化关系:
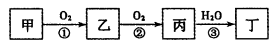
下列说法中错误的是
A.甲可能是单质,也可能是化合物
B.丁可能是酸,也可能是碱
C.反应①②一定是氧化还原反应
D.反应③一定是化合反应
查看答案和解析>>
科目:高中化学 来源:2015年期中备考总动员高三化学模拟卷【福建】3(解析版) 题型:简答题
(15分)氯化亚铜(CuCl)是一种白色固体,微溶于水,不溶于酒精。研究该物质的应用新领域、生产新方法及生产过程中的环保新措施都具有重要意义。
(1)镁—氯化亚铜海水电池,可用于鱼雷上。该电池被海水激活时,正极导电能力增强,同时产生气泡,则正极上被还原的物质有 、 (填化学式)。
(2)工业上以铜作催化剂,氯代甲烷和硅粉反应合成甲基氯硅烷的过程中产生大量废渣(主要成分为硅粉、铜、碳等)。某课外小组以该废渣为原料制CuCl,流程示意图如下:

回答下列问题:
①氯代甲烷有4种,其中属于重要工业溶剂的是 (写出化学式)。
②“还原”阶段,SO32-将Cu2+还原得[CuCl2]-,完成下列离子方程式。
 Cu2++
Cu2++ Cl-+
Cl-+ SO32-+
SO32-+ =
= [CuCl2]-+
[CuCl2]-+ +
+
③在稀释过程中存在下列两个平衡:
ⅰ.[CuCl2]- CuCl+Cl- K=2.32
CuCl+Cl- K=2.32
ⅱ.CuCl(s) Cu+(aq)+Cl- Ksp=1.2×10-6
Cu+(aq)+Cl- Ksp=1.2×10-6
当[CuCl2]-完成转化时(c([CuCl2]-)≤1.0×10-5 mol·L-1),溶液中c(Cu+)≥ 。
④获得CuCl晶体需经过滤、洗涤、干燥。洗涤时,常用无水乙醇代替蒸馏水做洗涤剂的优点是 (写一点)。
(3)工业生产CuCl过程中产生浓度为2~3 g·L-1的含铜废水,对人及环境都有较大的危害,必须进行回收利用。用萃取法富集废水中的铜,过程如下:

①实验室完成步骤ⅰ时,依次在分液漏斗中加入曝气后的废水和有机萃取剂,经振荡并 后,置于铁架台的铁圈上静置片刻,分层。分离上下层液体时,应先 ,然后打开活塞放出下层液体,上层液体从上口倒出。
②写出步骤ⅱ的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源:2015年期中备考总动员高三化学模拟卷【福建】3(解析版) 题型:选择题
下列有关实验原理、操作及安全知识的叙述,正确的是
A.不慎将苯酚固体粉末沾在皮肤上,立即用大量热水(>65℃)冲洗
B.在用标准盐酸滴定未知浓度NaOH溶液时,滴定前,酸式滴定管尖嘴处有气泡,而在滴定后气泡消失,会使测定结果偏低
C.把玻璃管插入橡胶塞孔时,可用厚布护手,紧握用水湿润的玻管,缓慢旋进塞孔中
D.银氨溶液、Cu(OH)2悬浊液、硫酸溶液、氯水在实验室里均不宜长期放置
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省盟校高三第一次十校联考理综化学试卷(解析版) 题型:填空题
【化学——选修2:化学与技术】(15分)海洋是一个丰富的资源宝库,通过海水的综合利用可获得许多物质供人类使用。
(1)海水中盐的开发利用:
①海水制盐目前以盐田法为主,建盐田必须选在远离江河入海口,多风少雨,潮汐落差大且又平坦空旷的海滩。所建盐田分为贮水池、 池和结晶池。
②工业上通常以NaCl、CO2和NH3为原料制取纯碱,请写出第一步制取NaHCO3的化学方程式: 。
(2)电渗析法是近年来发展起来的一种较好的海水淡化技术,其原理如图所示。其中具有选择性的阴离子交换膜和阳离子交换膜相间排列。请回答下面的问题:
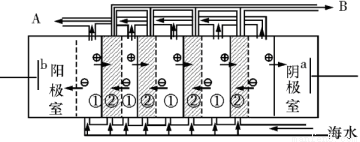
ⅰ电渗析法淡化海水中阴极室可获得的重要化工原料有 。
ⅱ上图中虚线部分表示 离子交换膜。淡水从 (A或B)排出。
(3)用苦卤(含Na+、K+、Mg2+、Cl-、Br-等离子)可提取溴,其生产流程如下:
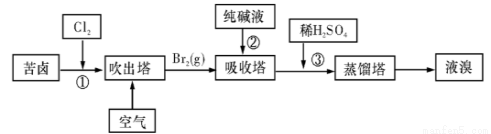
ⅰ.写出反应③的离子方程式为: 。
ⅱ.通过①氯化已获得含Br2的溶液,为何还需经过吹出、吸收、酸化来重新获得含Br2的溶液? 。
ⅲ.向蒸馏塔中通入水蒸气加热,控制温度在90℃左右进行蒸馏的原因是 。。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省宿迁市三校高三下学期3月质量检测化学试卷(解析版) 题型:实验题
(12分)某科研小组在900℃的空气中合成出化学式为La2Ca2MnOx的超导体材料,其中La以+3价存在。为确定x的值,进行如下分析:
步骤1:准确称取0.5250g超导体材料样品,放入锥形瓶中,加25.00mL0.06000mol·L-1 Na2C2O4溶液(过量)和25mL 6mol·L-1 HNO3溶液,在6070℃下充分摇动,约半小时后得到无色透明溶液A(该条件下,只有Mn元素被还原为Mn2+,Na2C2O4被氧化为CO2)。
步骤2:用0.02000mol·L-1 KMnO4溶液滴定溶液A至终点,消耗10.00mL KMnO4溶液。
(1)步骤1反应后溶液中Mn2+的物质的量浓度为0.02000mol·L-1。常温下,为防止Mn2+形成Mn(OH)2沉淀,溶液的pH的范围为 [已知Mn(OH)2的Ksp=2.0×10-13]。
(2)步骤2滴定终点的现象是 。
(3)步骤2滴定终点读数时俯视刻度,其他操作都正确,则所测x的值将 (填“偏大”、“偏小”或“不变”)。
(4)求x的值(写出计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com