
明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量的氧化铁杂质。具体实验流程如下:
明矾石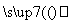


请回答下列问题:
(1)操作1所用到的玻璃仪器的名称是____________。
(2)由溶液3制取氢氧化铝的离子方程式为__________________________。
(3)明矾石焙烧时产生SO2,请你写出能验证SO2具有还原性且实验现象明显的化学方程式:______________。
(4)请你写出验证溶液1中有NH 的实验过程:________________________。
的实验过程:________________________。
(5)实验室用Fe2O3与CO反应来制取单质Fe。
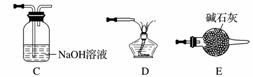
①请按气流由左到右的方向连接下列各装置,顺序为A→________。
②检查装置A气密性的方法是________________________________________________________________________。
③在点燃B处的酒精灯前,应进行的操作是__________________。
④装置C的作用是________________。

解析 (1)操作1是过滤,过滤操作所需要的玻璃仪器为玻璃棒、烧杯和漏斗。(2)经氨水浸泡,过滤得到固体氢氧化铝和少量氧化铁固体,再加入试剂1氢氧化钠溶液并过滤,得到溶液3偏铝酸钠溶液,最后通入CO2得到氢氧化铝。(3)检验SO2的还原性方法较多,可以用氯水、溴水或酸性高锰酸钾溶液来检验SO2具有还原性。(4)检验NH 时,应先加入浓NaOH溶液,然后加热,再用湿润的红色石蕊试纸或蘸有浓盐酸的玻璃棒进行检验。(5)先用NaOH溶液除去CO中的CO2杂质,再通过碱石灰吸收水蒸气,再通过B中红热的氧化铁,再通过NaOH溶液洗气除去反应产生的CO2,最后点燃未反应的CO。
时,应先加入浓NaOH溶液,然后加热,再用湿润的红色石蕊试纸或蘸有浓盐酸的玻璃棒进行检验。(5)先用NaOH溶液除去CO中的CO2杂质,再通过碱石灰吸收水蒸气,再通过B中红热的氧化铁,再通过NaOH溶液洗气除去反应产生的CO2,最后点燃未反应的CO。
答案 (1)玻璃棒、烧杯和漏斗 (2)AlO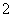 +2H2O+CO2===Al(OH)3↓+HCO
+2H2O+CO2===Al(OH)3↓+HCO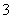 (3)SO2+Cl2+2H2O===H2SO4+2HCl(其他合理答案也可) (4)取少量溶液1,加入浓NaOH溶液后加热,有能使湿润的红色石蕊试纸变蓝的气体产生,证明有NH
(3)SO2+Cl2+2H2O===H2SO4+2HCl(其他合理答案也可) (4)取少量溶液1,加入浓NaOH溶液后加热,有能使湿润的红色石蕊试纸变蓝的气体产生,证明有NH (其他合理答案也可)
(其他合理答案也可)
(5)①E→B→C→D ②将导气管插入水槽中,关闭弹簧夹a和活塞b,微热圆底烧瓶,导管口有气泡产生,撤去热源,导管中形成一段稳定的水柱 ③检查CO的纯度 ④除去CO中的CO2,有利于点燃CO


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
含有砒霜(As2O3)的试样和锌、盐酸混合反应,生成的砷化氢(AsH3)在热玻璃管中完全分解成单质砷和氢气。若砷的质量为1.50 mg,则( )
A.被氧化的砒霜为1.98 mg
B.分解产生的氢气为0.672 mL
C.和砒霜反应的锌为3.90 mg
D.转移的电子总数为6×10-5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
某金属和硝酸反应,已知参加反应的被还原的硝酸和参加反应的硝酸的物质的量之比为1∶6,若已知还原产物唯一,则还原产物为( )
A.N2 B.N2O C.NO D.NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙两同学研究Na2SO3溶液与FeCl3溶液反应的情况。
| 步骤 | 操作 | 现象 |
| Ⅰ | 向2 mL 1 mol·L-1FeCl3溶液中加入一定量的Na2SO3溶液 | 溶液由棕黄色变为红褐色,并有少量刺激性气味的气体逸出 |
(1)常温下,FeCl3溶液的pH________7(填“<”、“>”或“=”)。
(2)分析红褐色产生的原因。
①甲同学认为步骤Ⅰ中溶液呈红褐色是因为生成了Fe(OH)3,用化学平衡移动原理解释溶液呈红褐色的原因:________________________________________________________________________。
②乙同学认为可能是发生了氧化还原反应,完成并配平其反应的离子方程式:
 Fe3++
Fe3++ SO
SO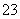 +
+ ________——
________—— Fe2++
Fe2++ ________+
________+ ________
________
 乙同学查阅资料得知:
乙同学查阅资料得知:
ⅰ.Fe2+与 反应生成墨绿色的絮状沉淀FeSO3;
反应生成墨绿色的絮状沉淀FeSO3;
ⅱ.墨绿色的FeSO3与黄色的FeCl3溶液混合后,溶液呈红褐色。
(3)甲同学为了确认溶液呈红褐色的原因是生成了Fe(OH)3,设计并完成了如下实验:
| 步骤 | 操作 | 现象 |
| Ⅱ | 用激光笔照射步骤Ⅰ中的红褐色溶液 | 出现“丁达尔效应” |
甲同学因此得出结论:溶液呈红褐色是因为生成了Fe(OH)3。而乙同学认为甲同学得出结论的证据仍然不足,乙同学的理由是________________________________________________________________________。
(4)为进一步确认Na2SO3溶液与FeCl3溶液反应的情况,乙同学设计并完成了如下实验:
| 步骤 | 操作 | 现象 |
| Ⅲ | 向1 mol·L-1的FeCl3溶液中通入一定量的SO2 | 溶液由黄色变为红褐色 |
| Ⅳ | 用激光笔照射步骤Ⅲ中的红褐色溶液 | 没有出现“丁达尔效应” |
①经检验步骤Ⅲ中红褐色溶液含有Fe2+,检验Fe2+选用的试剂是________(填字母)。
a.K3[Fe(CN)6]溶液
b.KSCN溶液
c.KMnO4溶液
②已知H2SO3是弱酸,请结合电离方程式说明步骤Ⅲ中出现红褐色的原因:________________________________________________________________________。
(5)结论:由上述实验得知,甲、乙两同学所持观点均正确。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室常用强氧化剂(如KMnO4、KClO3、MnO2等)氧化浓盐酸的方法来制备氯气,某研究性学习小组欲探究用Na2O2与浓盐酸制备并检验氯气。供选用的实验试剂及装置如下图所示(部分导管、蒸馏水略)。
a.Na2O2 b.浓盐酸 c.碱石灰 d.NaOH溶液 e.淀粉KI溶液 f.CaCO3 g.石蕊溶液 h.饱和NaCl溶液
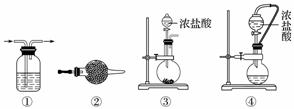
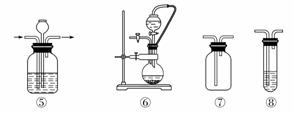
(1)写出用Na2O2与浓盐酸制备氯气的化学方程式:______________。
(2)下表中的装置组合最合理的是__________(填字母,需考虑实验结束撤除装置时残留有害气体的处理)。
| 组合 | 制备装置 | 净化装置 | 检验装置/试剂 | 尾气处理装置 |
| A | ③ | ② | ⑦/e | ⑤ |
| B | ③⑥ | ① | ⑧/g | ① |
| C | ④ | ① | ⑤/e | ② |
| D | ⑥ | ⑤ | ⑧/g | ① |
(3)尾气经处理后仍有较多气体排出,其主要原因可用化学方程式表示为________________________________________________________________________。
(4)某小组成员建议用双氧水代替过氧化钠进行实验更好,请你给出两条合适的理由:
①________________________________________________________________________;
②________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
能说明BF3分子的4个原子在同一平面的理由是( )
A.两个键之间的夹角为120°
B.B—F键为非极性共价键
C.3个B—F键的键能相同
D.3个B—F键的键长相等
查看答案和解析>>
科目:高中化学 来源: 题型:
碘在科研与生活中有重要应用。某兴趣小组用0.50 mol·L-1 KI、0.2%淀粉溶液、0.20 mol·L-1 K2S2O8、0.10 mol·L-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知:S2O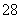 +2I-===2SO
+2I-===2SO +I2 (慢)
+I2 (慢)
I2+2S2O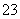 ===2I-+S4O
===2I-+S4O (快)
(快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的________________耗尽后,溶液颜色将由无色变为蓝色。为确保能观察到蓝色,S2O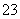 与S2O
与S2O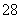 初始的物质的量需满足的关系为n(S2O
初始的物质的量需满足的关系为n(S2O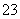 )∶n(S2O
)∶n(S2O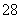 )________________。
)________________。
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
| 实验序号 | 体积V/mL | ||||
| K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
| ① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| ② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
| ③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
表中Vx=______________,理由是_______________________________________
________________________________________________________________________。
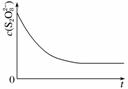
(3)已知某条件下,浓度c(S2O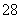 )~反应时间t的变化曲线如图所示,若保持其他条件不变,请在坐标图中,分别画出降低反应温度和加入催化剂时c(S2O
)~反应时间t的变化曲线如图所示,若保持其他条件不变,请在坐标图中,分别画出降低反应温度和加入催化剂时c(S2O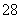 )~t的变化曲线示意图(进行相应的标注)。
)~t的变化曲线示意图(进行相应的标注)。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其他有机物)。
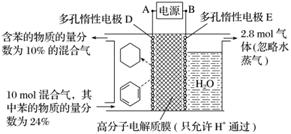
①导线中电子移动方向为________。(用A、D表示)
②生成目标产物的电极反应式为__________________________________________________。
③该储氢装置的电流效率η=________。(η=生成目标产物消耗的电子数/转移的电子总数×100%,计算结果保留小数点后1位)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com