
| 物质 | 开始沉淀时的pH | 完全沉淀时的pH |
| 氢氧化铁 | 2.7 | 3.7 |
| 氢氧化亚铁 | 7.6 | 9.6 |
| 氢氧化铜 | 5.2 | 6.4 |
| 18x |
| 135+18x |


科目:高中化学 来源: 题型:
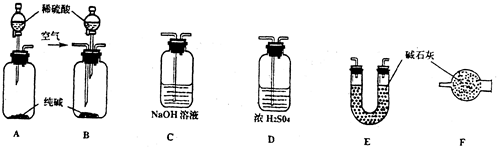
| A、日常生活中看到的云、烟、雾 |
| B、向豆浆中加入石膏制得可口的豆腐 |
| C、蒸发饱和食盐水析出氯化钠晶体 |
| D、向沸水中逐滴加入饱和的FeCl3溶液,得到红褐色透明的分散系 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③④⑧ | B、①②⑥⑨ |
| C、③⑤⑥⑦ | D、①③④⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
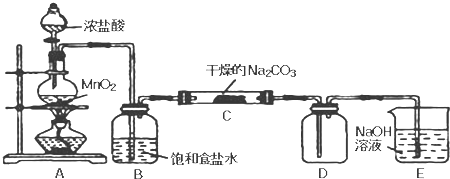
| 工业纯碱样品质量 | 反应前E的总质量 | 反应后E的总质量 |
| 5.5g | 43.9g | 46.1g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实 验 步 骤 | 预 期 现 象 和 结 论 |
| 步骤1:取C中的少量固体样品于试管中,加入蒸馏水至固体溶解,然后各取1~2mL所得溶液分别置于 甲、乙两支试管中. | 得到无色溶液 |
| 步骤2:向甲试管中加入过量的BaCl2溶液,静置. | 若溶液变浑浊,证明固体中含有 |
| 步骤3:取甲试管中上层清液少许于另一只试管中, 滴加少量 | 若 证明固体中含有NaHCO3. |
| 步骤4:向乙试管中 | 若 证明固体中含有 |
查看答案和解析>>
科目:高中化学 来源: 题型:

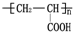 的单体,则A中所含官能团的名称是
的单体,则A中所含官能团的名称是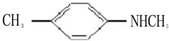 、
、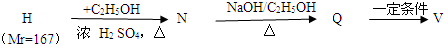
查看答案和解析>>
科目:高中化学 来源: 题型:

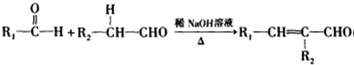 (R1、R2为烃基或氢原子);
(R1、R2为烃基或氢原子); (R1、R2为烃基)
(R1、R2为烃基)查看答案和解析>>
科目:高中化学 来源: 题型:
 )是有机工业的重要原料,可用于合成多种有机物.
)是有机工业的重要原料,可用于合成多种有机物.
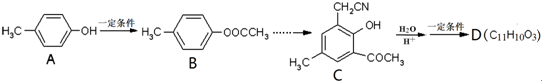
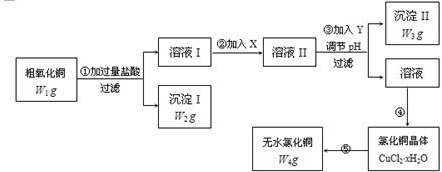
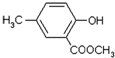 ,合成路线流程图为:
,合成路线流程图为: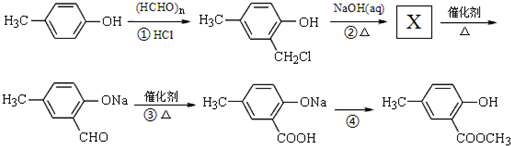
 的合成路线流程图表示(有机物用结构简式,注明反应试剂和条件)
的合成路线流程图表示(有机物用结构简式,注明反应试剂和条件)| 反应试剂 |
| 反应条件 |
| 反应试剂 |
| 反应条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 次数 | 1 | 2 | 3 | 4 |
| 加入氢氧化钠溶液的质量(g) | 25 | 25 | 25 | 25 |
| 生成沉淀的质量(g) | 2.9 | X | 8.7 | 8.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com