
| 400℃~500℃ |
| 500℃~600℃ |
| 700℃~800℃ |

| 44 |
| 100 |
| 4.4 |
| x |
| 56×2 |
| 56×2+16×3 |
| 元素的质量比 |
| 相对原子质量比 |
| 22.4g |
| 56 |
| 6.4g |
| 16 |


科目:高中化学 来源: 题型:
| A、用蔗糖做食品的甜味剂 |
| B、用甲醛侵泡水产品 |
| C、用干冰保存易腐败的食品 |
| D、用袋装生石灰做饼干类食品的干燥剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
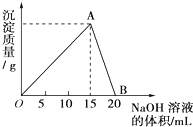 向20mL某浓度的AlCl3溶液中滴加2mol/L的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如图所示:
向20mL某浓度的AlCl3溶液中滴加2mol/L的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
| 离子 | H+ | K+ | NO3-[来源:.Com] | SO42- |
| 物质的量(mol) | 0.5 | 0.1 | 0.6 | 0.15 |
查看答案和解析>>
科目:高中化学 来源: 题型:
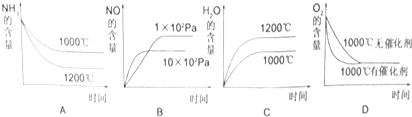
| 时间/浓度(mol/L) | C(NH3) | C(O2) | C(NO) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.2 |
| 第4min | 0.3 | 0.975 | 0.5 |
| 第6min | 0.3 | 0.975 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com