
分析 ①根据元素对应的原子结构判断元素在周期表中的位置;元素的原子结构示意图中,电子层数与其周期数相等,根据价电子数及电子所在轨道判断族序数;
②葡萄糖里有两种碳原子,葡萄糖是无羟基醛,一种是以sp3杂化,一种是以sp2杂化.
解答 解:(1)①Zn是30号元素,根据核外电子排布规律可知,Zn的电子排布式为1s22s22p63s23p63d104s2或[Ar]3d104s2,电子层数等于周期数,位于周期表第四周期,
其3d、4s能级上电子是其价电子,价电子排布式为3d104s2,所以位于第ⅡB族,
故答案为:四;ⅡB;1s22s22p63s23p63d104s2或[Ar]3d104s2;
②葡萄糖里有两种碳原子,葡萄糖是无羟基醛,所以,一种是以sp3杂化(接羟基的碳),一种是以sp2杂化(醛基里的碳),
故答案为:sp2、sp3.
点评 本题考查了基态原子的核外电子排布式以及原子杂化方式的判断,题目难度不大,解题时要熟悉常见元素在周期表中的位置,掌握价层电子对互斥理论的熟练应用.


科目:高中化学 来源: 题型:选择题
| A. | 离子化合物NH4Cl中既存在离子键,又存在极性共价键 | |
| B. | H2S的电子式是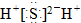 | |
| C. | 化学键包括离子键、共价键、氢键等 | |
| D. | LiOH、NaOH、KOH的碱性逐渐减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,混合气体颜色变浅 | |
| B. | 平衡时,NO2浓度必定等于N2O4浓度的两倍 | |
| C. | 平衡时,反应不在进行 | |
| D. | 平衡时,各组分浓度不再随时间的延长而发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将0.5molN2和1.5molH2充入一密闭容器中充分反应,放出热量19.6KJ则该热化学方程式为N2(g)+3 H2(g)?2NH3(g)△H=-39.2 KJ•mol-1 | |
| B. | 由C(石墨)=C(金刚石);△H=+1.9 kJ/mol,可知金刚石比石墨稳定 | |
| C. | 在稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ的热量 | |
| D. | 在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-285.8kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ②③④ | C. | ①③⑤ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12gC与16gO2所具有的总能量一定高于28gCO所具有的能量 | |
| B. | 56gCO所具有的能量大于88gCO2所具有的总能量 | |
| C. | 12gC和32gO2所具有的总能量大于44gCO2所具有的总能量 | |
| D. | 将一定质量的碳燃烧,生成CO2比生成CO时放出的热量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 金属质量/g | 金属状态 | c(H2SO4)/mol.L-1 | v(H2SO4)/mL | 溶液温度反应前/℃ | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 20 | 44 | 40 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
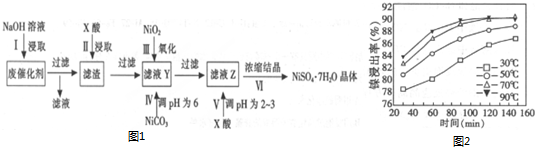
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 9.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com