
| A. | 用铝丝作高压电缆 | B. | 用不锈钢碗存放食醋 | ||
| C. | 用铝槽车运输浓硫酸 | D. | 用硬铝作制航天器的材料 |
分析 A.铝具有良好的导电性,可用作电缆;
B.食醋中含有醋酸,醋酸能和铁反应生成醋酸亚铁;
C.浓硫酸具有强的氧化性,常温下能够使铝钝化;
D.合金的性质是:硬度大,熔点低,耐腐蚀等.
解答 解:A.铝为活泼金属,具有良好的导电性,用铝丝作高压电缆是利用其导电性,故A正确;
B.用不锈钢碗存放食醋,食醋中的乙酸和不锈钢中的铁反应,不锈钢被腐蚀,故B错误;
C.浓硫酸具有强的氧化性,常温下能够使铝钝化形成致密氧化膜阻止反应进行,所以能用铝槽车运输浓硫酸,能说明浓硫酸具有强氧化性,故C正确;
D.铝属于轻金属,硬铝属于铝的合金,硬度大,耐腐蚀,可用硬铝作制航天器的材料,故D正确;
故选B.
点评 本题考查铝的性质以及合金,为高频考点,侧重于化学与生活、生产的考查,有利于培养学生良好的科学素养,难度不大.


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:解答题
| 分子式/结构式 | NO/N≡O | CO/C≡O | CO2/O=C=O | N2/N≡N |
| 化学键 | N≡O | C≡O | C=O | N≡N |
| 键能(KJ/mol) | 632 | 1072 | 750 | 946 |
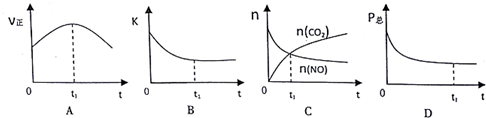
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/×10-2mol | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| n(CO)/×10-1mol | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
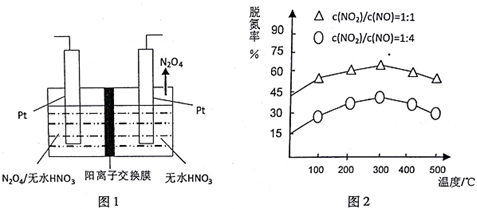
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使广泛pH试纸显蓝色的溶液:K+、Na+、CH3COO-、Br- | |
| B. | 甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl- | |
| C. | 0.1 mol?L-1 FeCl3溶液:K+、NH4+、I-、SCN- | |
| D. | 由水电离的c (H+)=1×10-14 mol?L-1的溶液中:Ca2+、K+、Cl-、HCO${\;}_{3}^{-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
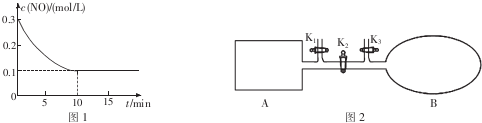
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向次氯酸钙溶液中通入少量的二氧化硫:Ca2++3ClO-+SO2+H2O═CaSO4+2HClO+Cl- | |
| B. | 向偏铝酸钠溶液中通入少量的二氧化碳:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- | |
| C. | 向硅酸钠水溶液中通入少量的二氧化碳:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| D. | 向次氯酸钠溶液中通入少量的二氧化碳:ClO-+CO2+H2O═HClO+HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤ | B. | ①②③⑤ | C. | ③④⑤ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com