
【题目】某Cr2O3样品中含有少量Al2O3、MgO等杂质.实验室以此样品为主要原料制取重铬酸钾(K2Cr2O7)的流程如下: 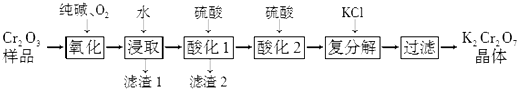
已知:2CrO42﹣+2H+Cr2O72﹣+H2O.
(1)上述氧化过程中,若将1mol Cr2O3转化成Na2CrO4 , 消耗氧气的体积(标准状况)是 .
(2)酸化1中为确保溶液中Al3+、AlO2﹣浓度均不超过10﹣6 molL﹣1 , 需调节溶液pH的范围是 . 已知:Al(OH)3(s)H++AlO2﹣+H2O的K=1×10﹣14;Ksp[Al(OH)3]=1×10﹣33
(3)酸化2后所得溶液加入KCl发生复分解反应,该反应能发生的原因是 .
(4)称取重铬酸钾试样2.40g 配成250mL溶液,取出25.00mL于碘量瓶中,加入稀硫酸和足量碘化钾(铬被还原为Cr3+)并放于暗处6min左右,然后加入适量水和数滴淀粉指示剂,用0.24molL﹣1 Na2S2O3标准溶液滴定至终点(发生反应:I2+2S2O32﹣═2I﹣+S4O62﹣ , 杂质不参与反应),共用去Na2S2O3标准溶液20.00mL.求所得产品中重铬酸钾的质量分数(写出计算过程).
【答案】
(1)33.6L
(2)5~8
(3)K2Cr2O7 溶解度小于Na2Cr2O7
(4)解:称取重铬酸钾试样2.40g配成250mL溶液,取出25.00mL于碘量瓶中,加入稀硫酸和足量碘化钾(铬被还原为Cr3+)并放于暗处6min左右,反应为Cr2O72﹣+6I﹣+14H+=2Cr3++3I2+7H2O,然后加入适量水和数滴淀粉指示剂,用0.24molL﹣1Na2S2O3标准溶液滴定至终点(发生反应:I2+2S2O32﹣=2I﹣+S4O62﹣,杂质不参与反应),共用去Na2S2O3标准溶液20.00mL,
依据反应的定量关系为:
K2Cr2O7~3I2~ | K2Cr2O7~3I2~ |
1 | 6 |
0.24molL﹣1 ×0.020L | n |
n=0.0008mol,
称取重铬酸钾试样2.40g配成250mL溶液中重铬酸钾质量,
m(K2Cr2O7)=0.0008mol×294g/mol× ![]() 2.352g,
2.352g,
产品中重铬酸钾的质量分数= ![]() ×100%=98.0%,
×100%=98.0%,
答:产品中重铬酸钾的质量分数= ![]() ×100%=98.0%.
×100%=98.0%.
【解析】解:流程分析可知,某Cr2O3样品中含有少量Al2O3、MgO等杂质,反应器中加入纯碱和氧气,将 Cr2O3转化成Na2CrO4 , 浸取过滤得到滤液调节溶液PH除去铝和镁离子,过滤得到Na2CrO4溶液,酸化后加入氯化钾浓缩过滤干燥得到重铬酸钾,(1)若将1mol Cr2O3转化成Na2CrO4 , Cr2O3~2Na2CrO4~6e﹣ , O2~4e﹣ , 得到
2Cr2O3~ | 3O2~12e﹣ |
2 | 3 |
1mol | 1.5mol |
消耗标准状况下氧气的体积=1.5mol×22.4L/mol=33.6L,
所以答案是:33.6;(2)依据电离平衡常数和溶度积常数计算所需溶液的PH范围,
Al(OH)3(s)H++AlO2﹣+H2O的K=c(AlO2﹣)×c(H+)=1×10﹣14 , c(H+)=10﹣8mol/L,溶液PH=8,Kap[Al(OH)3]=c(Al3+)×c3(OH﹣)=1×10﹣33 , c(OH﹣)=10﹣9mol/L,c(H+)=10﹣5mol/L,溶液PH=5,酸化1中为确保溶液中Al3+、AlO2﹣浓度均不超过10﹣6 molL﹣1 , 需调节溶液pH值的范围是5~8,所以答案是:5~8;3)操作中加入KCl的原因温度对氯化钠的溶解度影响小,但对重铬酸钾的溶解度影响较大,K2Cr2O7 溶解度小于Na2Cr2O,利用复分解反应,可得到重铬酸钾;所以答案是:K2Cr2O7 溶解度小于Na2Cr2O7;


科目:高中化学 来源: 题型:
【题目】(1)①Cu ②CO2 ③H2SO3④H2O⑤液态HCl ⑥H2SO4⑦Ba(OH)2 ⑧NaCl ⑨蔗糖 ⑩NaOH溶液
上述物质中属于电解质的是______________,属于非电解质的是________,能导电的是_________。 (填序号,必须填全,否则不得分)
(2)与16g氧气所含原子总数相同的氨气是_________________g。
(3)已知实验室制取氯气的反应原理为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
①该反应中氧化剂和还原剂的物质的量之比为________
②当2 mol MnO2参加反应时转移电子______mol
③当转移1 mol电子时能生成标准状况下的Cl2______L
④浓盐酸在反应中显示出来的性质是______(填字母)
a.还原性 b.酸性 c.氧化性 d. 挥发性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列仪器在使用之前需要检查是否漏液的是( )
①分液漏斗 ②容量瓶 ③长颈漏斗 ④普通漏斗
A. ①② B. ①②③ C. ②③④ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能获得成功的是
A. 苯与浓溴水用铁作催化剂制溴苯B. 可用分液漏斗分离硝基苯和水
C. 将苯与浓硝酸混合共热制硝基苯D. 加入水后分液可除去溴苯中的溴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,某NaOH稀溶液中,c(H+)=10﹣amol/L,c(OH﹣)=10﹣bmol/L,已知a+b=12.
(1)该温度下,水的离子积常数Kw= .
(2)在该温度下,将100mL0.1mol/L的稀硫酸与100mL0.4mol/L的NaOH溶液混合后,溶液的pH= , 此时该溶液中由水电离的c(OH﹣)= .
(3)该温度下,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】糖类、油脂、蛋白质是食物中的常见有机物。下列有关说法中,正确的是
A. 糖类是储存机体代谢所需能量的主要物质
B. 油脂在人体中发生水解的产物是氨基酸
C. 蛋白质主要由C、H、O、N四种元素组成
D. 糖类物质都有甜味
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠具有强碱性和强氧化性,遇木炭、铝粉等还原性物质时可燃烧。下列有关说法中不正确的是
A. Na2O2与炭、铝粉等还原性物质的燃烧实验可以在硬质玻璃管中进行
B. Na2O2与木炭的反应时Na2O2表现出强氧化性
C. Na2O2与Al反应的方程式为:2Al + 3Na2O2![]() 3 Na2O + Al2O3
3 Na2O + Al2O3
D. Na2O2与SO2反应可生成Na2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com