
| A. | 8个中子的碳原子的核素符号:12C | B. | 乙烯分子的结构简式:CH2=CH2 | ||
| C. | Cl-离子的结构示意图: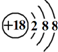 | D. | CH4分子的球棍模型: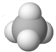 |
分析 A.质量数=质子数+中子数;
B.乙烯的分子式为C2H4,含有1个C=C键;
C.Cl-离子的核电荷数为17,核外电子数为18;
D.球棍模型应该用小球和短棍表示.
解答 解:A.8个中子的碳原子的质量数为8+6=14,故该核素的符号为:14C,故A错误;
B.乙烯的分子式为C2H4,含有1个C=C键,结构简式为CH2=CH2,故B正确;
C.Cl-离子的核电荷数为17,核外电子数为18,故结构示意图为: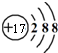 ,故C错误;
,故C错误;
D.球棍模型应该用小球和短棍表示,甲烷为正四面体结构,其正确的球棍模型为: ,故D错误.
,故D错误.
故选B.
点评 本题考查原子符合、结构简式、离子结构示意图球棍模型与比例模型等化学用语的判断,难度中等.注意掌握常见化学用语的表示方法,明确球棍模型与比例模型的区别.


科目:高中化学 来源: 题型:选择题
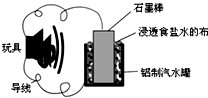 利用生活中常见的材料可以进行很多科学实验,如图就是一个用废旧材料制作的可用于驱动玩具的电池示意图.当电池工作时,有关说法正确的是( )
利用生活中常见的材料可以进行很多科学实验,如图就是一个用废旧材料制作的可用于驱动玩具的电池示意图.当电池工作时,有关说法正确的是( )| A. | 铝罐将逐渐被腐蚀 | |
| B. | 该电池驱动电动玩具时,石墨棒应与玩具电机的负极相连 | |
| C. | 石墨棒上发生的反应为:O2-4e-+2H2O═4OH- | |
| D. | 该电池工作一段时间后石墨棒的质量会减轻 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F六种元素为原子序数依次增大的短周期元素.A为原子半径最小的元素,A和B可形成4原子10电子的分子X;C的最外层电子数是内层的3倍; D原子的最外层电子数是最内层电子数的一半;E是地壳中含量最多的金属元素;F元素的最高正价与最低负价代数和为6.请回答下列问题:
A、B、C、D、E、F六种元素为原子序数依次增大的短周期元素.A为原子半径最小的元素,A和B可形成4原子10电子的分子X;C的最外层电子数是内层的3倍; D原子的最外层电子数是最内层电子数的一半;E是地壳中含量最多的金属元素;F元素的最高正价与最低负价代数和为6.请回答下列问题: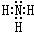 ;D可以在液态X中发生类似于与A2C的反应,写出反应的化学方程式2Na+2NH3=2NaNH2+H2↑.
;D可以在液态X中发生类似于与A2C的反应,写出反应的化学方程式2Na+2NH3=2NaNH2+H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O和H2O2两种分子中O原子的杂化类型相同 | |
| B. | NH3和NH4+两种微粒的空间结构相同 | |
| C. | SO42-和ClO4-两种微粒的键角相等 | |
| D. | SO2和O3两种分子是等电子体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,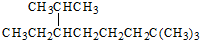 的名称为2,2,7-三甲基-6-乙基辛烷 的名称为2,2,7-三甲基-6-乙基辛烷 | |
| B. | 青蒿素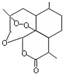 是抗恶性疟疾特效药,其分子式为C15H20O5 是抗恶性疟疾特效药,其分子式为C15H20O5 | |
| C. | 1mol达菲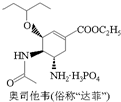 最多能与4molNaOH反应 最多能与4molNaOH反应 | |
| D. | CH3CH=CH-CH=CH2与溴的四氯化碳溶液发生加成反应最多可生成3种产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
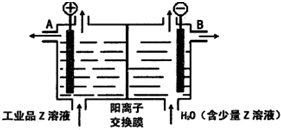
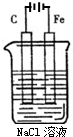 如图是电解NaCl溶液的示意图.请回答下列问题:
如图是电解NaCl溶液的示意图.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
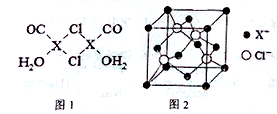 元素X的基态原子中的电子共有7个能级,且最外层电子数为1,X原子的内层轨道全部排满电子,在气体分析中,常用XCl的盐酸溶液吸收并定量测定CO的含量,其化学反应如下:2XCl+2CO+2H2O═X2Cl2•2CO•2H2O.
元素X的基态原子中的电子共有7个能级,且最外层电子数为1,X原子的内层轨道全部排满电子,在气体分析中,常用XCl的盐酸溶液吸收并定量测定CO的含量,其化学反应如下:2XCl+2CO+2H2O═X2Cl2•2CO•2H2O.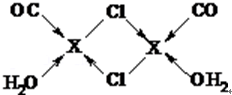 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com