
分析 (1)该反应的正反应是放热反应,升高温度正逆反应速率都增大,但平衡逆向移动;
(2)催化剂能同等程度的改变正逆反应速率;
(3)化学平衡常数K=$\frac{{c}^{3}(C)}{{c}^{2}(A).c(B)}$,该反应的正反应是放热反应,升高温度平衡逆向移动;
(4)平衡时A的浓度为0.02mol/L,剩余A的物质的量=0.02mol/L×2L=0.04mol,A的平均反应速率=$\frac{\frac{0.2mol-0.02mol/L×2L}{2L}}{30min}$=0.0027mol/(L.min),根据同一反应同一时间段内各物质的反应速率之比等于其计量数之比得C的反应速率为;
(5)将D、C完全转化为A、B知,生成A、B物质的量分别是0.2molA、0.1molB,所以与原来加入A、B的物质的量相等,则为等效平衡;
(6)减小容器体积,相当于增大压强,平衡逆向移动.
解答 解:(1)该反应的正反应是放热反应,升高温度正逆反应速率都增大,v(正)<v(逆),平衡向逆反应方向移动,故答案为:<;逆反应;
(2)催化剂能同等程度的增大正逆反应速率但平衡不移动,故答案为:增大;增大;
(3)化学平衡常数K=$\frac{{c}^{3}(C)}{{c}^{2}(A).c(B)}$,该反应的正反应是放热反应,升高温度平衡逆向移动,生成物浓度降低、反应物浓度增大,所以平衡常数减小,
故答案为:$\frac{{c}^{3}(C)}{{c}^{2}(A).c(B)}$;减小;
(4)平衡时A的浓度为0.02mol/L,剩余A的物质的量=0.02mol/L×2L=0.04mol,A的转化率=$\frac{0.2mol-0.04mol}{0.2mol}×100%$=80%,A的平均反应速率=$\frac{\frac{0.2mol-0.02mol/L×2L}{2L}}{30min}$=0.0027mol/(L.min),根据同一反应同一时间段内各物质的反应速率之比等于其计量数之比计算C的反应速率0.0405mol/(L.min),
故答案为:80%;0.0405mol/(L.min);
(5)将D、C完全转化为A、B知,生成A、B物质的量分别是0.2molA、0.1molB,所以与原来加入A、B的物质的量相等,则为等效平衡,所以c(A)=0.02mol/L,
故答案为:=;
(6)减小容器体积,相当于增大压强,平衡逆向移动,则c(A)>0.04mol/L,故答案为:>.
点评 本题考查化学平衡计算、化学平衡影响因素等知识点,侧重考查分析计算能力,会根据反应方程式特点确定平衡移动方向,难点是平衡有关计算,题目难度不大.


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:解答题
| 元素代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(nm) | 0.186 | 0.160 | 0.152 | 0.143 | 0.110 | 0.099 | 0.075 | 0.074 |
| 主要化合价 | +1 | +2 | +1 | +3 | +5、-3 | +7、-1 | +5、-3 | -2 |
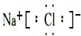 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
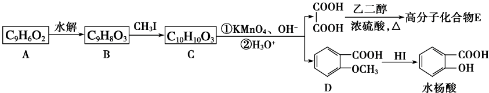
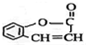 .
. .
.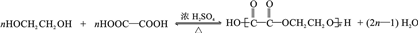 .
.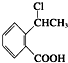 为原料制
为原料制 的合成路线流程图(无机试剂任用),在方框中填出相应的物质,并在括号注明反应条件.合成路线流程图示例如下:
的合成路线流程图(无机试剂任用),在方框中填出相应的物质,并在括号注明反应条件.合成路线流程图示例如下: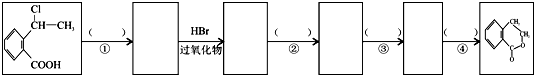
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
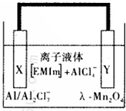 铝是一种高能量载体,是开发电池的理想电极材料.如图所示的室温铝二次电池,采用有机阳离子(EMlm)和 AlCl4-组成的离子液体为电解液,有关反应为Al+Mn2O4$?_{充电}^{放电}$AlMn2O4 下列说法正确的是( )
铝是一种高能量载体,是开发电池的理想电极材料.如图所示的室温铝二次电池,采用有机阳离子(EMlm)和 AlCl4-组成的离子液体为电解液,有关反应为Al+Mn2O4$?_{充电}^{放电}$AlMn2O4 下列说法正确的是( )| A. | 电池放电时,Ac-4-向Y极扩散 | |
| B. | 电池放电时,X是正极 | |
| C. | 电池充电时X极的反应为:4Al2Cl7-+3e-=Al+7AlCl4- | |
| D. | 铝作为负极材料的比能量高于锂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
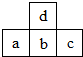 图为周期表中短周期的一部分.若a原子最外层电子数比次外层电子数少3个,则下列说法中不正确的是( )
图为周期表中短周期的一部分.若a原子最外层电子数比次外层电子数少3个,则下列说法中不正确的是( )| A. | 原子半径的大小顺序是c>b>a>d | |
| B. | c的氢化物比a的氢化物稳定 | |
| C. | b和d可结合成bd32-和bd42-阴离子 | |
| D. | a、b、c的最高价氧化物对应水化物的酸性强弱关系是c>b>a |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
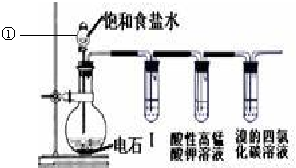
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | T/K | 锌规格 | 盐酸浓度/mol•L-1 | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究盐酸浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究锌规格(粗、细)对该反应速率的影响. |
| ② | 298 | |||
| ③ | 308 | |||
| ④ | 298 |
| 时间(S) | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| 氢气体积 (ml) | 16.8 | 39.2 | 67.2 | 224 | 420 | 492.8 | 520.8 | 543.2 | 554.4 | 560 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com