
A.分子正、负电荷重心重合 B.分子中只有极性键
C.H2O2是极性分子 D.分子中有π键
 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:
 (1)在烷烃的系统命名法中甲基不能出现在1号位置,乙基能否出现在2号位置?
(1)在烷烃的系统命名法中甲基不能出现在1号位置,乙基能否出现在2号位置? 在一定条件下发生消去反应的方程式:
在一定条件下发生消去反应的方程式:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
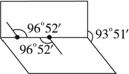
 已知H2O2分子的结构如图所示:H2O2分子不是直线型的两个H原子犹如在半展开的书的两线上,氧原子则在书的夹缝上,书页夹角为93°52′,而两个O-H键与O-O键的夹角均为96°52′.
已知H2O2分子的结构如图所示:H2O2分子不是直线型的两个H原子犹如在半展开的书的两线上,氧原子则在书的夹缝上,书页夹角为93°52′,而两个O-H键与O-O键的夹角均为96°52′.查看答案和解析>>
科目:高中化学 来源: 题型:

图2-12
试完成下列问题:
(1)写出H2O2分子的结构式。
(2)H2O2分子内有______________(填“极性键”或“非极性键”)。
(3)估计它难溶于CS2,简要说明原因。
(4)指出氧元素的化合价,简要说明原因。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com