
分析 (1)根据外界条件对平衡的影响来确定平衡移动方向,从而确定溶液颜色变化;
(2)根据判断平衡状态的方法:V正=V逆,或各组分的浓度保持不变则说明已达平衡,也可根据化学平衡状态的特征:逆、定、动、变、等来回答判断;
(3)在氧化还原反应中,化合价升高值=化合价降低值=转移电子数来计算;
(4)根据Ksp=c(Cr3+)•c3(OH-)来计算氢氧根离子离子的浓度,并计算氢离子浓度和pH的大小;Cr(OH)3是难溶电解质,在溶液中存在沉淀溶解平衡;
(5)阳极是活性电极时,阳极本身失电子,生成阳离子,Cr2O72-与亚铁离子发生氧化还原反应;
(6)溶液PH升高的原因是溶液中氢离子浓度减少,即氢离子在阴极得电子,PH升高,氢氧根离子浓度增大,离子浓度幂的乘积大于溶度积,所以金属阳离子会生成氢氧化物沉淀.
解答 解:(1)pH=12时溶液呈碱性,2CrO42- (黄色)+2H+?Cr2O72-(橙色)+H2O向逆向移动,溶液呈黄色,故答案为:黄;
(2)对于平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O,
a.Cr2O72-和CrO42-的浓度相同,不一定平衡,故a错误;
b.2υ(Cr2O72-)=υ(CrO42-)不能证明正逆速率相等,所以不是平衡状态,故b错误;
c.溶液的颜色不变,即有色离子浓度不会再不变,达到了化学平衡状态,故c正确;
故答案为:ab;
(3)还原0.1mol Cr2O72-离子,铬元素化合价从+6价降低到+3价,一共得到电子0.6mol,亚铁离子被氧化为+3价,应该得到0.6mol电子,所以还原0.1mol Cr2O72-离子,需要0.6mol的FeSO4•7H2O,
故答案为:0.6;
(4)Ksp=c(Cr3+)•c3(OH-)=10-32,若将溶液的pH调至5,c(H+)=10-5mol/L,c(OH-)=10-9mol/L,c(Cr3+)=$\frac{1{0}^{-32}}{(1{0}^{-9})^{3}}$=mol/L=10-5mol/L,
故答案为:10-5;
(5)在电解法除铬中,铁作阳极,阳极反应为Fe-2e-═Fe2+,以提供还原剂Fe2+,与Cr2O72-发生氧化还原反应,离子方程式为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,
故答案为:提供还原剂Fe2+;Fe-2e-═Fe2+;Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
(6)在阴极附近溶液pH升高的原因是水电离产生的H+放电生成H2:2H++2e-═H2↑;同时大量产生了OH-,所以溶液中的Fe3+也将转化为Fe(OH)3沉淀;
故答案为:2H++2e-═H2↑;Fe(OH)3.
点评 本题主要考查了铬及其化合物的性质、氧化还原反应、沉淀溶解平衡和电化学知识等内容,为高频考点,侧重于学生的分析、实验和计算能力的考查,难度中等,抓住题目信息是解题的关键,注意把握氧化还原反应原理以及溶度积在计算中的应用.


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案科目:高中化学 来源: 题型:解答题
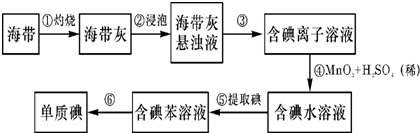
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=+242 kJ/mol | B. | 2H2(g)+O2(g)═2H2O(l)△H=-484 kJ/mol | ||
| C. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+242 kJ/mol | D. | 2H2(g)+O2(g)═2H2O(g)△H=+484 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3- | |
| B. | 常温下pH=12的溶液:Na+、K+、SiO32-、NO3- | |
| C. | c(Fe3+)=0.1mol•L-1的溶液:H+、Al3+、I-、SCN- | |
| D. | 加入铝粉生成H2的溶液:K+、Mg2+、SO42-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgNO3溶液中加入过量的氨水:Ag++NH3•H2O=AgOH↓+NH4+ | |
| B. | 铵明矾[NH4Al(SO4)2•12H2O]溶液中加入过量Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O | |
| C. | H2O2溶液中滴加酸性KMnO4溶液:2 MnO4-+5 H2O2+6H+=2Mn2++5O2↑+8H2O | |
| D. | 尼泊金酸(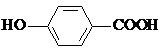 )与碳酸氢钠溶液反应: )与碳酸氢钠溶液反应: |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

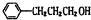 $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$ +H2O;该反应的反应类型为酯化反应或取代反应
+H2O;该反应的反应类型为酯化反应或取代反应 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
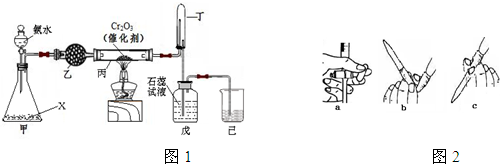
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Si用于制造光导纤维 | |
| B. | 过氧化钠可用作潜艇供氧剂 | |
| C. | 水玻璃浸泡过的木材既能防腐又能耐火 | |
| D. | 常温下,铁槽、铝槽可存放冷的浓硝酸、浓硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com