

| A. | ①>②>③ | B. | ③>②>① | C. | ③>①>>② | D. | ②>①>③ |
分析 先判断装置是原电池还是电解池,再根据原电池正负极腐蚀的快慢比较,作原电池负极和电解池阳极的金属易被腐蚀,作原电池正极或电解池阴极的金属易被保护,金属腐蚀快慢顺序是:电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护腐蚀措施的腐蚀.
解答 解:根据图知,②③装置是电解池,②中金属铁为阴极,Fe被保护,③中金属铁为阳极,Fe被腐蚀,①装置铁的反应速度未受到保护也未受到抑制,所以①中铁的腐蚀比②中的快,
所以:铁在其中被腐蚀由快到慢的顺序为③>①>>②.
故选C.
点评 本题考查了金属的腐蚀与防护,难度不大,明确不同条件下金属腐蚀的快慢:电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护腐蚀措施的腐蚀.


 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:解答题
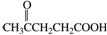 合成聚芳酯E的路线:
合成聚芳酯E的路线: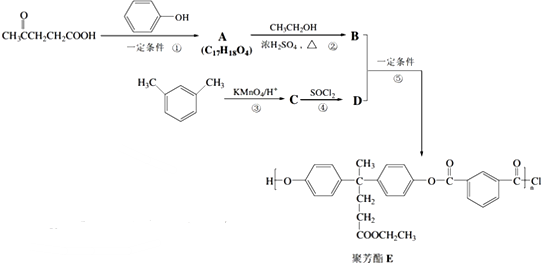
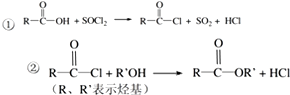
 .
. .
.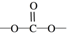 结构
结构 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 酸雨的PH为5.6 | |
| B. | 酸雨的形成过程发生了氧化还原反应 | |
| C. | 酸雨的主要成分为氮、硫元素的氧化物 | |
| D. | 形成酸雨的主要原因是因为雷雨天气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K值不变,平衡可能移动 | |
| B. | 平衡向右移动时,K值不一定移动 | |
| C. | K值有变化,平衡一定移动 | |
| D. | 相同条件下,同一个反应的方程式的化学计量数增大2倍,K值也增大两倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | R原子核外一定有4个电子层 | |
| B. | R原子最外层电子数一定为4 | |
| C. | R的气态氧化物比电子层数相同的其他非金属元素的气态氢化物稳定 | |
| D. | R元素气态氢化物的化学式为H2R |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高一上10月月考化学试卷(解析版) 题型:选择题
下列关于电解质的叙述中,正确的是
①硫酸银在水中的溶解度很小,其溶液的导电能力很弱,所以硫酸银是弱电解质
②碳酸钙在水中的溶解度虽小,但溶解的部分全部电离,所以碳酸钙是强电解质
③氨气的水溶液导电性很好,所以它是强电解质
④水难电离,纯水几乎不导电,所以水是弱电解质
A.② B.① C.①③ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 “温室效应”是哥本哈根气候变化大会研究的环境问题之一.CO2是目前大气中含量最高的一种温室气体.因此,控制和治理CO2是解决“温室效应”的有效途径.
“温室效应”是哥本哈根气候变化大会研究的环境问题之一.CO2是目前大气中含量最高的一种温室气体.因此,控制和治理CO2是解决“温室效应”的有效途径.| 温度(K) CO2转化率(%) n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com