
| A. | 1.8 g | B. | 6.5 g | C. | 3 g | D. | 10 g |
分析 三种金属中产生等量的氢气质量最大的为锌,质量最小的为铝.用极端假设法进行分析,假设混合物全部是锌或全部是铝,根据生成氢气,分别计算出它们的质量,混合物的质量介于最大值和最小值之间的值,据此判断.
解答 解:标况下,2.24L氢气的物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,
设要生成H20.1mol需要锌的质量为y,则:
Zn+H2SO4═ZnSO4+H2↑
65g 1mol
y 0.1mol
解得y=$\frac{65g×0.1mol}{1mol}$=6.5g
设要生成H2 0.1mol需要铝的质量为z,则:
2Al+3H2SO4═Al2(SO4)3+3H2↑
54g 3mol
z 0.1mol
解得z=$\frac{54g×0.1mol}{3mol}$=1.8g
所以混合物的质量介于1.8g~6.5g,
故选:C.
点评 本题考查混合物的有关计算,难度中等,解答本题关键是用极端假设法考虑问题的思路,“极端假设法”是用数学方法解决化学问题的常用方法,可分别假设原混合物是某一纯净物,计算出各自的质量,混合物的质量介于最大值和最小值之间.


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案 小学学习好帮手系列答案
小学学习好帮手系列答案科目:高中化学 来源: 题型:多选题
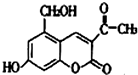 某种利胆解痉药的有效成分是“亮菌甲素”,其结构简式如图.关于“亮菌甲素”的说法中,正确的是( )
某种利胆解痉药的有效成分是“亮菌甲素”,其结构简式如图.关于“亮菌甲素”的说法中,正确的是( )| A. | “亮菌甲素”的分子式为C12H10O5 | |
| B. | 1mol“亮菌甲素”与溴水的反应,最多消耗3mol Br2 | |
| C. | 1mol“亮菌甲素”最多能和6mol H2发生加成反应 | |
| D. | 1mol“亮菌甲素”最多能和2mol NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Na+、CO32- | B. | Ba2+、SO42-、Cl- | C. | K+、H+、OH- | D. | Ag+、Al3+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO的燃烧热为283 kJ | |
| B. | 图可表示由CO生成CO2的反应过程和能量关系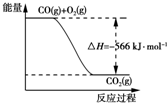 | |
| C. | 2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H=-452 kJ•mol-1 | |
| D. | CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为1.204×1024 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,1.5 mol NO2的体积约为33.6 L | |
| B. | NaOH的摩尔质量是40 g | |
| C. | 100 mL水中溶解了8.4 g NaHCO3,则溶液中Na+的物质的量浓度为1 mol/L | |
| D. | 同温同压下,相同体积的C12和SO2气体所含的分子数一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的二氧化硫和氨气,前者体积大 | |
| B. | 标况下22.4升 HCl通入水中溶液中含氯化氢分子为0.1 mol | |
| C. | 任何条件下相同物质的量的两种气体含有相同数目的分子 | |
| D. | 标况下2 molH2的摩尔质量是4g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径的周期性变化 | B. | 电负性的周期性变化 | ||
| C. | 第一电离能的周期性变化 | D. | 原子核外电子排布的周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质溴是一种红棕色液体 | B. | 溴水可使湿润的淀粉KI试纸变蓝 | ||
| C. | 单质碘易升华 | D. | 碘单质是从海水中大量提取的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com