
【题目】NH3经一系列反应可以得到HNO3和NH4NO3,如图1所示.
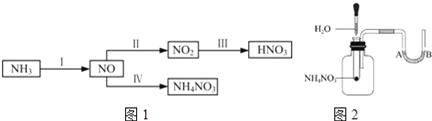
【资料卡片】
i.NH4NO3是一种白色晶体,易溶于水,微溶于乙醇.
ii.在230℃以上时,同时有弱光:2NH4NO3═2N2↑+O2↑+4H2O
iii.在400℃以上时,剧烈分解发生爆炸:4NH4NO3═3N2↑+2NO2+8↑H2O
(1)如图2将水滴入盛有硝酸铵的试管中,观察到的A处液面上升,B处液面下降,产生该现象的原因________.一段时间后还能观察到的现象是____________.
(2)实验室可以用氯化铵和熟石灰反应来制备氨气,该反应的化学方程式是______,能否用硝酸铵代替氯化铵,______(填“能”或“不能”),理由是______.
(3)从反应类型角度分析在I~IV的转化过程中的共同点是___________________。
【答案】 硝酸铵溶于水吸收热量,集气瓶中气体受冷,压强减小 A处液面下降,B处液面上升,水平导管中液柱向右移动 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O 不能 硝酸铵受热易爆炸 都是氧化还原反应
CaCl2+2NH3↑+2H2O 不能 硝酸铵受热易爆炸 都是氧化还原反应
【解析】(1)硝酸铵易溶于水,溶解时吸收热量,温度降低,压强减小,所以观察到的A处液面上升,B处液面下降;硝酸铵见光分解生成氮气和二氧化氮,集气瓶中压强增大,因此一段时间后还能观察到的现象是A处液面下降,B处液面上升,水平导管中液柱向右移动;(2)氯化铵与氢氧化钙在加热条件下反应生成氨气、氯化钙和水,反应的化学方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;硝酸铵受热易爆炸,所以不能用硝酸铵代替氯化铵;(3)转化中氨气中氮元素为-3价,经过反应Ⅰ生成一氧化氮,一氧化氮中氮元素为+2价,一氧化氮与氧气反应生成二氧化氮,二氧化氮中氮元素为+4价,二氧化氮与水反应生成硝酸和一氧化氮,硝酸中氮元素为+5价,一氧化氮发生反应Ⅳ生成硝酸铵,硝酸铵中氮元素化合价为-3价和+5价,所以在I~IV的转化过程中都存在元素化合价变化,都属于氧化还原反应。
CaCl2+2NH3↑+2H2O;硝酸铵受热易爆炸,所以不能用硝酸铵代替氯化铵;(3)转化中氨气中氮元素为-3价,经过反应Ⅰ生成一氧化氮,一氧化氮中氮元素为+2价,一氧化氮与氧气反应生成二氧化氮,二氧化氮中氮元素为+4价,二氧化氮与水反应生成硝酸和一氧化氮,硝酸中氮元素为+5价,一氧化氮发生反应Ⅳ生成硝酸铵,硝酸铵中氮元素化合价为-3价和+5价,所以在I~IV的转化过程中都存在元素化合价变化,都属于氧化还原反应。


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】某强酸性溶液X,可能含有Al3+、Ba2+、NH ![]() 、Fe2+、Fe3+、CO
、Fe2+、Fe3+、CO ![]() 、SO
、SO ![]() 、SiO
、SiO ![]() 、NO
、NO ![]() 中的一种或几种离子,取该溶液进行实验,其现象及转化如图.反应过程中有一种气体是红棕色. 请回答下列问题:
中的一种或几种离子,取该溶液进行实验,其现象及转化如图.反应过程中有一种气体是红棕色. 请回答下列问题: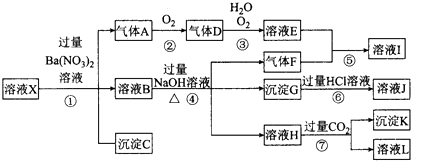
(1)由强酸性条件即可判断溶液X中一定不存在的离子有 .
(2)溶液X中,关于N03﹣的判断一定正确的是 . a.一定有 b.一定没有 c.可能有
(3)产生气体A的离子方程式为 .
(4)转化⑥发生反应的现象为 .
(5)转化④中产生H的离子方程式为 .
(6)若转化③中,D、H2O、O2三种物质恰好发生化合反应生成E,则反应中D与O2的物质的量之比为
(7)对不能确定是否存在的离子,可以另取X溶液,加入下列溶液中的一种,根据现象即可判断,该试剂最好是 ①NaOH溶液,②KSCN溶液,③石蕊试剂,④pH试纸,⑤KMnO4溶液,⑥氯水和KSCN的混合溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.02molL﹣1MOH溶液滴定100mL0.01molL﹣1HA溶液,如图为加入MOH溶液的体积与混合溶液的pH变化情况(溶液体积变化勿略不计).回答下列问题: 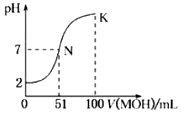
(1)由图中信息可知HA为酸(填“强”或“弱”),滴定所用的最适宜指示剂为 , 滴定时眼睛注视 .
(2)常温下一定浓度的MA稀溶液的pH=a,则a7(填“大于”、“小于”或“等于”)此时,溶液中水电离出的c(OH﹣)=mol/L.
(3)请写出K点所对应的溶液中离子浓度的由大到小的关系: .
(4)K点所对应的溶液中,c(M+)+c(MOH)2c(A﹣);(填“大于”“小于”“等于”)
(5)室温下MOH溶液加水稀释过程中,下列数值变小的是(填序号) ①c(H+) ② ![]() ③c(OH﹣) ④
③c(OH﹣) ④ ![]() .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,水溶液中H+和OH﹣的浓度变化曲线如图,下列说法正确的是( ) 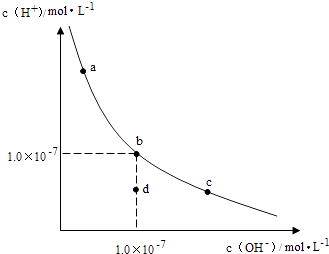
A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10﹣13
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一小粒钠投入氯化铜溶液中,待反应停止后,观察到的现象是( )
A. 有蓝色沉淀 B. 有蓝色沉淀和气体产生
C. 有气体产生,无沉淀生成 D. 无沉淀和有气体产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度.则100℃时1molL﹣1的NaOH溶液中,由水电离出的c(H+)=molL﹣1 , KW(25℃)KW(100℃)(填“>”、“<”或“=”).25℃时,向水的电离平衡体系中加入少量NH4HCO3固体,对水的电离平衡的影响是(填“促进”、“抑制”或“不影响”). 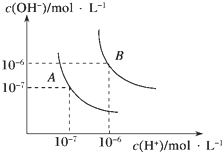
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验室常用甲酸(HCOOH)和浓硫酸混合加热制备一氧化碳,其反应方程式为: HCOOH ![]() CO↑+H2O.
CO↑+H2O.
如图是制备一氧化碳还原三氧化二铁并检验反应产物结束时的实验装置.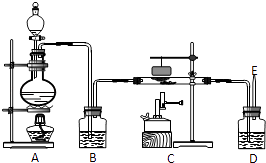
(1)实验前先检查装置的气密性;起始时应检验 , 以防止爆炸;
(2)装置B中盛放 , 除去;
(3)装置D中盛放 , 检验;
(4)写出C装置中反应的化学方程式;
(5)实验结束时应先停止处加热;
(6)在反应后磁铁悬挂在玻璃管上方,其作用是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com