
【题目】氧元素与多种元素具有亲和力,所形成化合物的种类很多。
(1)氮、氧、氟元素的第一电离能从大到小的顺序为__________。氧元素与氟元素能形成OF2分子,氧原子轨道杂化类型__________。
(2)根据等电子体原理,NO2+的空间构型是__________;1 molN O2+中含有的π键数目为__________个。
(3)氧元素和过渡元素可形成多种价态的金属氧化物,如和铬可生成Cr2O3、CrO3、CrO5等。基态铬原子外围电子排布式为__________。
(4)下列物质的分子与O3分子的结构最相似的是__________。
A.H2O B.CO2 C.SO2 D.BeCl2
(5)O3分子是否为极性分子?__________。
【答案】 F>N>O sp3杂化 直线形 2NA 3d5 4s1 C 是
【解析】试题分析:本题主要考查第一电离能、中心原子杂化、等电子体、π键、电子排布等基础知识,考查考生基础知识的掌握情况及基础知识在解题中的运用能力。
解析:(1)同周期从左到右,各元素的第一电离能呈增大的趋势,但是处于全满和半满状态是一种亚稳定结构,第一电离能比相邻的元素高,所以三种元素的第一电离能大小顺序为F>N>O。OF2分子中,中心原子O有2个成键对,孤对数目为![]() ,因此O采用sp3杂化。正确答案:F>N>O、sp3杂化。(2)NO2+含有3原子,价电子数为16,与CO2属于等电子体,所以结构为直线形,结合CO2分子结构可知,1molCO2分子中含有2molπ键,所以1molNO2+中含有2molπ键。正确答案:直线形、2×6.02×1023。(3)铬是24号元素,核外电子排布为[Ar]3d54s1,因此外围电子排布是3d54s1。正确答案:3d54s1。(4)根据等电子体原理,O3价电子数目为18,H2O价电子数目为8,CO2的价电子数目为16,SO2的价电子数目为18,BeCl2的价电子数目为16,而各分子中含有的原子数均为3,因此O3与SO2是等电子体,二者的结构相似。正确答案:C。(5)SO2分子中,中心原子S成键电子对数为2,孤对电子数为
,因此O采用sp3杂化。正确答案:F>N>O、sp3杂化。(2)NO2+含有3原子,价电子数为16,与CO2属于等电子体,所以结构为直线形,结合CO2分子结构可知,1molCO2分子中含有2molπ键,所以1molNO2+中含有2molπ键。正确答案:直线形、2×6.02×1023。(3)铬是24号元素,核外电子排布为[Ar]3d54s1,因此外围电子排布是3d54s1。正确答案:3d54s1。(4)根据等电子体原理,O3价电子数目为18,H2O价电子数目为8,CO2的价电子数目为16,SO2的价电子数目为18,BeCl2的价电子数目为16,而各分子中含有的原子数均为3,因此O3与SO2是等电子体,二者的结构相似。正确答案:C。(5)SO2分子中,中心原子S成键电子对数为2,孤对电子数为![]() ,所以中心原子S采取sp2杂化,分子构型为V形,所以他的等电子体O3也是V形结构,但是O3分子中中心O原子与外侧O原子的孤对电子对数不同(外侧O两对孤对,中心O一对孤对),所以O3是极性分子。正确答案:是。
,所以中心原子S采取sp2杂化,分子构型为V形,所以他的等电子体O3也是V形结构,但是O3分子中中心O原子与外侧O原子的孤对电子对数不同(外侧O两对孤对,中心O一对孤对),所以O3是极性分子。正确答案:是。


 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】聚乙烯醇缩甲醛有热塑性,耐磨,可以制造高强度漆包线。由A制备聚乙烯醇缩甲醛等的合成路线(部分反应条件略去)如下所示:

回答下列问题:
(1)A的结构简式是________,B含有的官能团名称是________;①的反应类型是______,⑦的反应类型是_________。
(2)B和C的结构简式分别为_______、_______。
(3)异戊二烯分子中最多有_____个原子共平面,顺式聚异戊二烯的结构简式为_______;写出与A具有相同官能团的异成二烯的所有同分异构体_______ (填结构简式)。
(4)参照异戊二烯的上述合成路线,设计一条由A和乙醛为起始原料制备1,3-丁二烯的合成路线_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子晶体的晶胞结构如图。(该晶胞可看成由8个小立方体构成,在每个小立方体的体心各有一个黑球,在大立方体的8个顶点和6个面心上各有一个白球)试求:
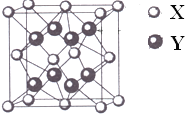
①晶体中每一个Y同时吸引着_____个X,每个X同时吸引着______个Y,该晶体的化学式是____________。
②晶体中在每个X周围与它最接近且距离相等X共有_____个。
③晶体中距离最近的2个X与一个Y形成的夹角(∠XYX)为___________。
④设该晶体的摩尔质量为M g/mol,晶胞密度为ρg/cm3,阿伏加德罗常数为NA,则晶体中两个最近的X间中心距离为____________cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应:A+B=C下列条件的改变一定能使化学反应速率加快的是:
A. 增加A的物质的量 B. 升高体系的温度
C. 增加体系的压强 D. 减少C的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知4NH3 + 5O2 = 4NO + 6H2O,若反应速率分别是ν(NH3)、ν(O2)、ν(NO)、ν(H2O气)(单位:molL-1min-1)。下列关系正确的是 ( )
A. 4/5ν(NH3)=ν(O2) B. 5/6ν(O2)=ν(H2O)
C. 2/3ν(NH3)=ν(H2O) D. 4/5ν(O2)=ν(NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 常温常压下,8 g O2含有4NA个电子
B. 1 L 0.1 mol·L-1的氨水中有0.1NA个NH4+
C. 标准状况下,22.4 L盐酸含有NA个HCl分子
D. 0.05 mol液态KHSO4中含有0.1NA个阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种离子晶体的晶胞如图,其中阳离子A以![]() 表示,阴离子B以
表示,阴离子B以![]() 表示。
表示。
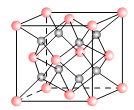
(1)每个晶胞中含A离子的数目为______,含B离子数目为_______。
(2)若A的核外电子排布与Ne相同,B的电子排布与Ar相同,则该离子化合物的化学式是___________;
(3)阳离子周围距离最近的阳离子数为_____,阳离子周围距离最近的阴离子数_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验在学科中有举足轻重的作用,结合下列实验的图示分析相关的描述正确的是( )
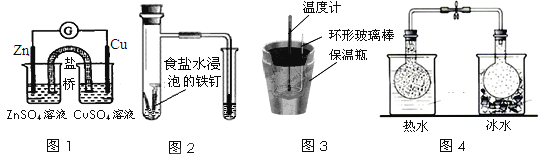
A. 图1:根据用电器(G)中指针的偏转方向可比较Zn、Cu的金属的活泼性
B. 图2:可根据小试管中液面的变化判断铁钉发生了析氢腐蚀
C. 图3:根据温度计读数的变化可测量浓硫酸和NaOH反应的中和热
D. 图4:根据两烧瓶中气体颜色的变化(热水中变深、冰水中变浅)可以判断2NO2(g)![]() N2O4(g)是一个吸热反应
N2O4(g)是一个吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com