
【题目】[化学——选修3:物质结构与性质]
氮的化合物在生产、生活中有广泛应用。
(1)氮化镓(GaN)是新型的半导体材料。基态氮原子的核外电子排布图为____;基态镓(Ga)原子的核外具有____种不同能量的电子。
(2)乙二氨的结构简式为(H2N-CH2-CH2-NH2,简写为en)。
①分子中氮原子轨道杂化类型为____;
②乙二氨可与铜离子形成配合离子[Cu(en)2]2+,其中提供孤电子对的原子是____,配合离子结构简式为____;
③乙二氨易溶于水的主要原因是____。
(3)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼(如图1)和六方氮化硼(如图2),前者类似于金刚石,后者与石墨相似。

①图1中氮原子的配位数为____,离硼原子最近且等距离的硼原子有____个;
②已知六方氮化硼同层中B与N之间的距离为acm,密度为dgcm-3,则相邻层与层之间的距离为____pm(列出表达式)。
【答案】![]() 8 sp3 N
8 sp3 N 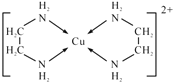 乙二氨与水形成分子间氢键,乙二氨分子与水分子均为极性分子 4 12
乙二氨与水形成分子间氢键,乙二氨分子与水分子均为极性分子 4 12 ![]() 1010
1010
【解析】
(1)氮原子核外有7个电子,电子排布式为1s22s22p3;镓为31号元素,电子排布式为1s22s22p63s23p63d104s24p1,依据电子排布式解答;
(2)①H2N-CH2-CH2-NH2中氮原子的价层电子对数为![]() (5+3)=4;
(5+3)=4;
②中心原子Cu2+提供空轨道,乙二氨分子中N原子提供孤对电子;
③乙二氨和水都是极性分子,相似相溶,乙二氨分子与水分子间可形成氢键。
(3)①观察晶胞结构发现N原子周围距离最近的B数目为4,即配位数为4;由图可知,晶胞为面心立方堆积,以顶点的N原子分析,位于面心的原子与之相邻,1个顶点原子为12个面共用,所以离N原子最近且等距离的N原子有12个,同理离硼原子最近且等距离的硼原子有12个;
②每个六棱柱平均含有一个N原子和一个B原子,两原子的相对原子质量之和为25,设层与层之间距离为h,六棱柱体积为![]() a2hcm3,六棱柱质量为
a2hcm3,六棱柱质量为![]() =
=![]() a2hdg,所以h=
a2hdg,所以h=![]() cm=
cm=![]() ×1010pm。
×1010pm。
(1)氮原子核外有7个电子,基态氮原子的核外电子排布图为![]() ;镓为31号元素,电子排布式为1s22s22p63s23p63d104s24p1,有8个不同的能层,所以基态镓(Ga)原子的核外具有8种不同能量的电子。
;镓为31号元素,电子排布式为1s22s22p63s23p63d104s24p1,有8个不同的能层,所以基态镓(Ga)原子的核外具有8种不同能量的电子。
故答案为:![]() ;8;
;8;
(2)①H2N-CH2-CH2-NH2中氮原子的价层电子对数为![]() (5+3)=4,所以轨道杂化类型为sp3;
(5+3)=4,所以轨道杂化类型为sp3;
②配合离子[Cu(en)2]2+中心原子Cu2+提供空轨道,乙二氨分子中N原子提供孤对电子,因此提供孤电子对的原子是N,配合离子结构简式为 ;
;
③乙二氨和水都是极性分子,相似相溶,乙二氨分子与水分子间可形成氢键,所以乙二氨易溶于水。
故答案为:sp3;N; ;乙二氨与水形成分子间氢键,乙二氨分子与水分子均为极性分子;
;乙二氨与水形成分子间氢键,乙二氨分子与水分子均为极性分子;
(3)①观察晶胞结构发现N原子周围距离最近的B数目为4,即配位数为4;由图可知,晶胞为面心立方堆积,以顶点的N原子分析,位于面心的原子与之相邻,1个顶点原子为12个面共用,所以离N原子最近且等距离的N原子有12个,同理离硼原子最近且等距离的硼原子有12个;
②选取晶体结构中最小的正六棱柱为计算单位,根据均摊法可以计算出每个六棱柱平均含有一个N原子和一个B原子,两原子的相对原子质量之和为25。已知六方氮化硼同层中B与N之间的距离为acm,则正六边形的边长为acm,设层与层之间距离为h,六棱柱体积为![]() a2hcm3,又知其密度为dgcm-3,则六棱柱质量为
a2hcm3,又知其密度为dgcm-3,则六棱柱质量为![]() =
=![]() a2hd g,所以h=
a2hd g,所以h=![]() cm=
cm=![]() ×1010pm,则层与层之间距离的计算表达式为
×1010pm,则层与层之间距离的计算表达式为![]() ×1010pm。
×1010pm。
故答案为:4;12;![]() 1010。
1010。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列溶液中Cl-浓度与50 mL 1 mol·L-1AlCl3溶液中Cl-浓度相等的是( )
A. 150 mL 1 mol·L-1的NaCl溶液B. 75 mL 2 mol·L-1NH4Cl溶液
C. 150 mL 2 mol·L-1的KCl溶液D. 100 mL 1.5mol·L-1的MgCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1 L容器中用O2将HCl转化为Cl2,反应方程式为:4HCl(g)+O2(g)![]() 2H2O(g)+2Cl2(g) ΔH<0,一定条件下测得反应过程中n(Cl2)的实验数据如下。下列说法正确的是( )
2H2O(g)+2Cl2(g) ΔH<0,一定条件下测得反应过程中n(Cl2)的实验数据如下。下列说法正确的是( )
t/min | 0 | 2 | 4 | 6 |
n(Cl2)/10-3 mol | 0 | 1.8 | 3.7 | 5.4 |
A. 0~2 min的反应速率小于4~6 min的反应速率
B. 2~6 min用Cl2表示的反应速率为0.9 mol/(L·min)
C. 增大压强可以提高HCl转化率
D. 平衡常数K(200 ℃)<K(400 ℃)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某高能锂离子电池的总反应为:2Li+FeS= Fe +Li2S,电解液为含LiPF6.SO(CH3)2的有机溶液(Li+可自由通过)。某小组以该电池为电源电解废水并获得单质镍,工作原理如图所示。

下列分析正确的是
A. 该锂离子电池正极反应为FeS+2Li++2e-=Fe +Li2S
B. X与电池的Li电极相连
C. 电解过程中c(BaC12)保持不变
D. 若去掉阳离子膜将左右两室合并,则X电极的反应不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如下装置制取氯气,并用氯气进行实验。回答下列问题:

(1)A中盛有浓盐酸,B中盛有MnO2,写出反应的离子方程式__________________________。
(2)E中为红色干布条,F中为红色湿布条,可观察到的现象是________________________,对比E和F中现象的差异可得出的结论及解释是________________________________。
(3)试管C和D中试剂各为_____________________________。
(4)装置G处发生反应的离子方程式为_______________________________。
(5)用离子方程式表示试剂X的作用_________________________。
(6)家庭中常用消毒液(主要成分NaClO)与洁厕灵(主要成分盐酸)清洁卫生。某品牌消毒液包装上说明如下图。

①“与洁厕灵同时使用”会产生有毒的氯气,写出反应的离子方程式__________________。
②需“密闭保存”的原因____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠常用作漂白剂。某化学小组设计实验制备亚氯酸钠,并进行杂质分析。
实验I 按图装置制备NaC1O2晶体

已知:①C1O2为黄绿色气体,极易与水反应。
②NaC1O2饱和溶液在低于38℃时析出NaC1O2·3H2O晶体,高于38℃时析出NaC1O2晶体,温度高于60℃时NaC1O2分解生成NaC1O3和NaCl。
(1)装置A中b仪器的名称是____;a中能否用稀硫酸代替浓硫酸____(填“能”或“不能”),原因是____。
(2)A中生成C1O2的化学反应方程式为____。
(3)C中生成NaC1O2时H2O2的作用是____;为获得更多的NaC1O2,需在C处添加装置进行改进,措施为____。
(4)反应后,经下列步骤可从C装置的溶液中获得NaC1O2晶体,请补充完善。
i.55℃时蒸发结晶 ii.__________ ii.用40℃热水洗涤 iv.低于60℃干燥,得到成品
实验Ⅱ 样品杂质分析
(5)上述实验中制得的NaC1O2晶体中还可能含有少量中学常见的含硫钠盐,其化学式为____,实验中可减少该杂质产生的操作(或方法)是____(写一条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以石墨负极(C)、LiFePO4正极组成的锂离子电池的工作原理如图所示(实际上正负极材料是紧贴在锂离子导体膜两边的)。充放电时,Li+在正极材料上脱嵌或嵌入,随之在石墨中发生了LixC6生成与解离。下列说法正确的是
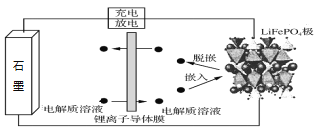
A. 锂离子导电膜应有保护成品电池安全性的作用
B. 该电池工作过程中Fe元素化合价没有发生变化
C. 放电时,负极材料上的反应为6C+xLi++ xe- =LixC6
D. 放电时,正极材料上的反应为LiFePO4 - xe- = Li1-xFePO4 + xLi+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究和深度开发CO、CO2的应用具有重要的社会意义。回答下列问题:
Ⅰ.CO可用于高炉炼铁,已知:
Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g) △H1=a kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H2=b kJ/mol
则反应Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)的△H3=________kJ/mol(用含a、b的代数式表示)。
Ⅱ.一定条件下,CO2和CO可以互相转化。
(1)某温度下,在容积为2L的密闭容器按甲、乙两种方式投入反应物发生反应:CO2(g)+H2(g)![]() CO(g)+H2O(g)。
CO(g)+H2O(g)。
容器 | 反应物 |
甲 | 8 mol CO2(g)、16 mol H2(g) |
乙 | w mol CO2(g)、x mol H2(g)、y mol CO(g)、z mol H2O(g) |
甲容器15 min后达到平衡,此时CO2的转化率为75%。则0~15 min内平均反应速率v(H2)=______,此条件下该反应的平衡常数K=______。
欲使平衡后乙与甲中相同组分气体的体积分数相等,则w、x、y、z需满足的关系是:y______z(填“>”、“<”或“=”),且y=______(用含x、w的等式表示)。
(2)研究表明,温度、压强对反应“C6H5CH2CH3(g)+CO2(g)![]() C6H5CH=H2(g)+CO(g) +H2O(g) △H ”中乙苯的平衡转化率影响如图所示:
C6H5CH=H2(g)+CO(g) +H2O(g) △H ”中乙苯的平衡转化率影响如图所示:

则△H_____0(填“>”、“<”或“=”),压强p1、p2、p3从大到小的顺序是________。
(3)CO可被NO2氧化:CO+NO2![]() CO2+NO。当温度高于225℃时,反应速率v 正=k正·c(CO)·c(NO2)、v逆=k逆·c(CO2)·c(NO),k正、k逆分别为正、逆反应速率常数。在上述温度范围内,k正、k逆与该反应的平衡常数K之间的关系为________。
CO2+NO。当温度高于225℃时,反应速率v 正=k正·c(CO)·c(NO2)、v逆=k逆·c(CO2)·c(NO),k正、k逆分别为正、逆反应速率常数。在上述温度范围内,k正、k逆与该反应的平衡常数K之间的关系为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为探究SO2和Fe(NO3)3溶液反应的实质,设计了如图所示装置进行实验。已知:1.0 mol·L-1的Fe(NO3)3溶液的pH=1。请回答下列问题:

(1)装置A中用于滴加浓硫酸的仪器名称为_________,装置A中发生的化学方程式是________。
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是________________。
(3)装置B中产生了白色沉淀,其成分是______________,说明SO2具有____________性。
(4)分析B中产生白色沉淀的原因。
观点1:SO2与Fe3+反应;
观点2:在酸性条件下SO2与![]() 反应。
反应。
观点3:___________________________;
①若观点1正确,装置B中反应的离子方程式是______________,证明该观点应进一步确认生成的新物质,其实验操作及现象是_______。
②按观点2,装置B中反应的离子方程式是___________。
③有人认为,如将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验,也可验证观点2是否正确。此时应选择最佳试剂是_________(填字母)。
A.3.0 mol·L-1 NaNO3溶液和0.1 mol·L-1硫酸等体积混合的溶液
B.6.0 mol·L-1 NaNO3溶液和0.2 mol·L-1盐酸等体积混合的溶液
C.1.5 mol·L-1 Fe(NO3)2溶液
D.1 mol·L-1稀硝酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com