
 通过电解饱和食盐水得到的氢氧化钠固体样品常含有氯化钠杂质.来来同学利用中和滴定原理测定氢氧化钠的质量分数.步骤为:
通过电解饱和食盐水得到的氢氧化钠固体样品常含有氯化钠杂质.来来同学利用中和滴定原理测定氢氧化钠的质量分数.步骤为:| 实验序号 | 待测样品溶液体积(mL) | 滴定管读数 | 消耗标准盐酸溶液的体积(mL) | |
| 初读数 | 末读数 | |||
| 1 | 20.00 | 0.00 | 19.95 | 19.95 |
| 2 | 20.00 | 0.05 | 19.90mL | 19.85mL |
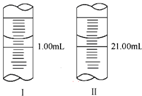
分析 (1)根据滴定管的结构、精确度以及量取的体积是两次读数之差;
(2)根据c=$\frac{1000ρω}{M}$计算浓盐酸的物质的量浓度;
(3)根据HCl+NaOH=NaCl+H2O计算NaOH的物质的量,然后求出质量分数.
解答 解:(1)滴定管液面读数为19.90mL,消耗标准NaOH溶液的体积为19.90mL-0.05mL=19.85mL,
故答案为:19.90mL;19.85mL;
(2)4.80%(密度是1.02g/mL)盐酸的物质的量浓度c(HCl)=$\frac{1000ρω}{M}$=$\frac{1.02×1000×0.0480}{36.5}$=1.3414mol/L;
答:盐酸的浓度为1.3414mol/L;
(3)HCl+NaOH=NaCl+H2O
1 1
1.3414mol/L×0.01985L n(NaOH)
所以n(NaOH)=1.3414×0.01985mol
氢氧化钠固体样品中氢氧化钠的质量分数为$\frac{1.3414×0.01985mol×40g/mol×\frac{200mL}{20mL}}{15.000g}$×100%=71.0%;
答:质量分数为71.0%.
点评 本题主要考查了物质含量的测定,难度不大,只要掌握对应知识即可完成,注意c=$\frac{1000ρω}{M}$计算是重要知识点.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
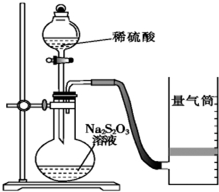 化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.
化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.| 实验序号 | 体积V/mL | 时间/s | |||
| Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
| ① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
| ② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
| ③ | 6.0 | 2.0 | 4.0 | Vx | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 分析化学常用草酸钠晶体(Na2C2O4溶液无色)作为基准物质测定酸性KMnO4溶液的浓度.
分析化学常用草酸钠晶体(Na2C2O4溶液无色)作为基准物质测定酸性KMnO4溶液的浓度.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
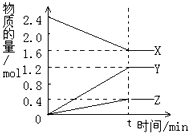 在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.依图所示:
在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.依图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y位于元素周期表的第2周期第IVA族 | |
| B. | X、Y、Z、W、M的原子半径由大到小的顺序为M>Y>Z>W>X | |
| C. | X、Z、W形成的盐中只含有离子键 | |
| D. | 产生刺激性气味气体的反应离子方程式为H++HSO3-=H2O+SO2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com