
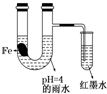
 ��ͼװ���У�������ʵ������ʼʱ����С�Թ��еĵ����ڵ�Һ���½���һ��ʱ����ڵ�Һ��������Ը���U���е�Һ�森�����йؽ��Ͳ��������ǣ�������
��ͼװ���У�������ʵ������ʼʱ����С�Թ��еĵ����ڵ�Һ���½���һ��ʱ����ڵ�Һ��������Ը���U���е�Һ�森�����йؽ��Ͳ��������ǣ�������| A�� | ����Ƭ��������̼����ǿ���Ŀ���ʴ�� | |
| B�� | ��ˮ���Խ�ǿ������Ƭ��ʼ�������ⸯʴ | |
| C�� | ������īˮҺ�����ʱ��������Ӧʽ��O2+2H2O+4e-�T4OH- | |
| D�� | ���ŷ�Ӧ�Ľ��У�U������ˮ���������� |
���� ������ˮ��pH=4����ʼ�����������ⸯʴ���ʿ�ʼʱ����С�Թ��еĵ����ڵ�Һ���½���һ��ʱ�����ˮ�����Լ�������ʱ������ʼ����������ʴ����һ��ʱ����ڵ�Һ��������Ը���U���е�Һ�棬�ݴ˷�����
��� �⣺A�������к��е�̼���ܺ����γ�ԭ��أ������������ӿ����ĸ�ʴ����A����
B����ˮ�����Խ�ǿ���ʿ�ʼʱ�������ⸯʴ����B��ȷ��
C��������īˮҺ���������������������������ʴ��������ӦΪO2+2H2O+4e-�T4OH-����C��ȷ��
D��������ˮ��pH=4����ʼ�����������ⸯʴ�������Ϸ�ӦΪ��2H++2e-=H2��������ˮ�����Լ�������D��ȷ��
��ѡA��
���� ���⿼������ĵ绯ѧ��ʴ��������ԭ��ع���ԭ���Ŀ��飬Ϊ�߿��������ͣ��ѶȲ���ע����������Ϣ��Ϊ������Ĺؼ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ú���ۺ�������Ҫ��ú�ĸ���Һ����������������ָ��C+H2O$\frac{\underline{\;����\;}}{\;}$CO+H2 | |
| B�� | ���½ṹ�մɵ����裨Si3N4���������������ǽ������ϣ��������������������� | |
| C�� | ������í�����������壬�����ױ���ʴ | |
| D�� | ��ͭ��ϡ���ᡢ����������������ͭ�������ˡ���ɫ��ѧ����˼�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CH4+Cl2$\stackrel{��}{��}$ CH3Cl+HCl | |
| B�� | CH3CH2OH+CH3COOH $��_{��}^{Ũ����}$ CH3COOCH2CH3+H2O | |
| C�� | H2C=CH2+HCl��H2C-CH2Cl | |
| D�� | 2CH3CH2OH+O2 $��_{��}^{Cu}$ 2CH3CHO+2H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
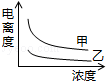 B��
B�� C��
C��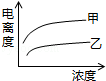 D��
D��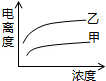
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ϩ����ʹ��ˮ��ɫ���ҷ�Ӧԭ����ͬ | |
| B�� | ��ϩ������ϩ������ͨ���ۺϷ�Ӧ�õ��߷��Ӳ��� | |
| C�� | ����ʽΪC8H10�����к��б����ṹ��ͬ���칹����3�� | |
| D�� | ��Ȳ�ͱ���Ϊ������������ֻ�ܷ����ӳɷ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
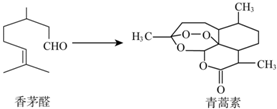
| A�� | ��éȩ��ʹBr2��CCl4��Һ��ɫ | |
| B�� | �����ط���ʽΪC15H22O5 | |
| C�� | ��������һ�������¿ɷ���ˮ�ⷴӦ | |
| D�� | ���߾��������������ӳɷ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
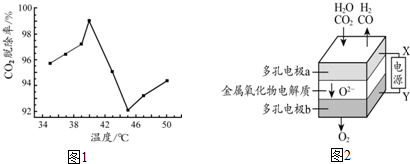
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CO��g���TC��s��+$\frac{1}{2}$O2��g�� | B�� | 2N2O5��g���T4NO2��g��+O2��g�� | ||
| C�� | ��NH4��2CO3��s���TNH4HCO3��s��+NH3��g�� | D�� | MgCO3��s���TMgO��s��+CO2��g�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com