
 甲醇(CH3OH)是一种重要的化工原料,也是一种比较理想的燃料.甲醇在各个领域有着广泛的应用.
甲醇(CH3OH)是一种重要的化工原料,也是一种比较理想的燃料.甲醇在各个领域有着广泛的应用.
分析 (1)根据盖斯定律,将已知反应(①-②-③×4)÷2得到CH3OH(l)+O2(g)=CO(g)+2H2O(l),焓变进行相应的改变;
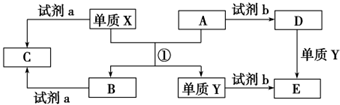
(2)甲池能自发的进行氧化还原反应,属于原电池,通入甲醇的电极为负极、通入氧气的电极为正极,则乙池、丙池是电解池,A、C属于阳极,B、D属于阴极,A电极反应式为氢氧根离子得电子生成氧气,B极反应式为Ag++e-=Ag、C极反应式为4OH-+4e-=2H2O+O2↑、D极反应式为Cu2++2e-=Cu;
(3)①平衡状态时正逆反应速率相等,各组分的浓度保持不变;
②要提高CO的转化率,应使平衡向正反应方向移动;
(4)正反应为吸热反应,压强一定时,升高温度,平衡向正反应方向移动,甲烷的转化率增大,据此判断温度大小.
解答 解:(1)根据盖斯定律,将已知反应(①-②-③×4)÷2得到CH3OH(l)+O2(g)=CO(g)+2H2O(l),所以该反应的△H=$\frac{1}{2}$[(-1275.6kJ/mol)-(-566.0kJ/mol)-(-44.0kJ/mol)×4]=-266.8kJ•mol-1,即CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-266.8kJ•mol-1,
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-266.8kJ•mol-1 ;
(2)①甲池能自发的进行氧化还原反应,属于燃料电池,为原电池,通入甲醇的电极为负极、通入氧气的电极为正极,乙为电解池,A连接原电池正极,则为阳极,
故答案为:阳极;
②碱性条件下,氧气得电子生成氢氧根离子,电极反应式为O2+2H2O+4e-=4OH-,
故答案为:O2+2H2O+4e-=4OH-;
③乙池为电解硝酸银溶液的电解池,生成Ag和氧气,电解方程式为4AgNO3+2H2O$\frac{\underline{\;电解\;}}{\;}$4Ag+O2↑+4HNO3,
故答案为:4AgNO3+2H2O$\frac{\underline{\;电解\;}}{\;}$4Ag+O2↑+4HNO3;
④丙池中C极反应式为4OH-+4e-=2H2O+O2↑、D极反应式为Cu2++2e-=Cu,当电路中通过0.01mol电子时,有0.01mol氢氧根离子反应,生成0.01mol氢离子,所以c(H+)=$\frac{0.01mol}{0.1L}$=0.1mol/L,溶液的pH=1,故答案为:1;
(3)①a.容器体积不变,混合气体的质量不变,所以密度始终不变,混合气体的密度保持不变不能说明反应达到平衡状态,故a错误;
b.该反应前后气体物质的量不同,恒容容器中混合气体的总压强保持不变,说明各组分浓度不变,反应达到平衡状态,故b正确;
c.CO的质量分数保持不变,说明反应达到平衡状态,故c正确;
d.甲醇的浓度保持不变,说明反应达到平衡状态,故d正确;
e.氢气以甲醇的化学计量数不同,v正(H2)=v逆(CH3OH),不能说明正逆反应速率相等,不能说明反应达到平衡状态,故e错误;
f.v(CO)=v(CH3OH),无法判断正逆反应速率相等,故f错误;
故答案为:bcd;
②要提高CO的转化率,应使平衡向正反应方向移动,
a.该反应放热,升温平衡逆向移动,故错误;
b.加入催化剂不影响平衡移动,故错误;
c.增加CO的浓度,CO的转化率降低,故错误;
d.加入H2平衡正向移动,CO的转化率增大,故正确;
e.体积不变加入惰性气体,平衡不移动,故错误;
f.分离出甲醇平衡正向移动,CO的转化率增大,故正确;
故答案为:df;
(4)由图开始,压强一定时,温度T2的转化率较大,正反应为吸热反应,升高温度,平衡向正反应方向移动,甲烷的转化率增大,故温度Tl<T2,故答案为:<.
点评 本题考查较综合,涉及化学平衡影响因素、化学平衡状态判断、盖斯定律、原电池和电解池原理等知识点,侧重考查学生分析判断及知识综合应用能力,会正确书写电极反应式,注意:只有反应前后改变的物理量才能作为化学平衡状态判断依据,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
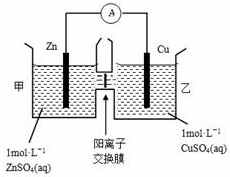
| A. | 铜电极上发生氧化反应 | |
| B. | 电池工作一段时间后,乙池溶液的总质量增加 | |
| C. | 电池工作一段时间后,乙池的c(Zn2+)>c(SO42-) | |
| D. | 阴、阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F六种元素为前四周期元素,原子序数依次增大.A的最高正价和最低负价的绝对值相等,B的基态原子的电子分布在3个不同的能级且各能级中电子数相等.D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子的s能级的电子总数与p能级的电子数相等,F的基态原子在同周期元素中未成对电子数最多.请回答下列问题:
A、B、C、D、E、F六种元素为前四周期元素,原子序数依次增大.A的最高正价和最低负价的绝对值相等,B的基态原子的电子分布在3个不同的能级且各能级中电子数相等.D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子的s能级的电子总数与p能级的电子数相等,F的基态原子在同周期元素中未成对电子数最多.请回答下列问题: ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 当m2-m3=2.96 g时,Fe3O4的质量至少为2.32g | |
| B. | 生成蓝色溶液的离子方程式为Cu+2Fe3+═Cu2++2Fe2+ | |
| C. | 要确定混合物中是否含有Al,可取A加入适量稀盐酸 | |
| D. | 当m1>m2时,溶液a中的阴离子只有1种 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
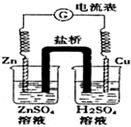
| A. | 随着反应进行,左烧杯中盐溶液浓度上升,右烧杯中酸溶液浓度下降 | |
| B. | 盐桥的作用是让电子通过,以构成闭合回路 | |
| C. | 随着反应进行,右烧杯中溶液pH变小 | |
| D. | 总反应为:2H++Zn═H2↑+Zn2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com