
��18�֣�
��1��������FeSO4��Һʱ���������������ۣ�Ŀ����___________________________________������������H2SO4��Ŀ����__________________________________________________��
��2������ĭ��������Al2(SO4)3��Һ��Լ1 mol��L-1����NaHCO3��Һ��Լ1 mol��L-1�������ݼ���ʹ��ʱ�����Ļ�ѧ��Ӧ�����ӷ���ʽ��_____________________________��
(3)����֪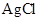 Ϊ������ˮ����İ�ɫ���壬
Ϊ������ˮ����İ�ɫ���壬 Ϊ������ˮ�����Ǻ�ɫ���塣
Ϊ������ˮ�����Ǻ�ɫ���塣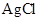 ��
��
ˮ������Һ�м���������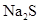 ��Һ���������ɫ������ȫת��Ϊ��ɫ���塣
��Һ���������ɫ������ȫת��Ϊ��ɫ���塣
�١�д����ɫ����ת����ɫ����Ļ�ѧ����ʽ�� ��
�ڡ���ɫ����ת���ɺ�ɫ�����ԭ���ǣ� ��
��4������֪����������20���µ�Ksp���£��Իش��������⣺
|
��ѧʽ |
�� AgCl |
�� AgBr |
�� Ag2S |
�� Ag2CrO4 |
|
Ksp |
2.0��10��10 |
5.4��10��13 |
2.0��10��48 |
2.0��10��12 |
��20��ʱ�������������α�����Һ�У�Ag�����ʵ���Ũ���ɴ�С��˳���ǣ�����ţ�
_____________________________��
����BaCl2��Һ�м���AgNO3��KBr�������ֳ�������ʱ����_______________ ��
��1����ֹFe2+������ (2��) ����ֹFe2+ˮ�⡣(2��)��
��2��Al3++ 3HCO3- =Al(OH)3 ��+ 3CO2�� (3��) (3) ��2AgCl+Na2S==Ag2S+2NaCl��3�֣���
����ΪAg2S���ܽ�ȱ�AgCl���ܽ��С�������ܽ�ƽ��������Ũ�ȼ�С�ķ����ƶ�����2�֣�
(4) �١��� >��>��>�� ��3�֣��� �ڡ�2.7��10��3����3�֣�
����������1�����������ױ��������������ӣ��������ۿ��Է�ֹFe2+����������������ˮ�����ԣ�����������Է�ֹFe2+ˮ�⡣
��2��������ˮ�������ԣ�̼������ˮ���Լ��ԣ�������ٽ�����������������CO2������ʽΪAl3++ 3HCO3- =Al(OH)3 ��+ 3CO2����
��3����ΪAg2S���ܽ�ȱ�AgCl���ܽ��С�������ܽ�ƽ��������Ũ�ȼ�С�ķ����ƶ��������Ȼ�����ת��Ϊ����������ʽΪ2AgCl+Na2S==Ag2S+2NaCl��
��4���ٸ����������ʵ��ܶȻ������Լ���ѧʽ��֪��������Һ��������Ũ�ȷֱ���1.4��10��5mol/L��7.3��10��7mol/L��1.6��10��16mol/L��1.6��10��4mol/L��������Һ��������Ũ�ȴ�С˳��Ϊ�� >��>��>�ۡ�
�ڸ�������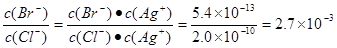



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�


| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ���仯��������Ȼ���й㷺���ڣ��������ԭ���ش��������⣺
���仯��������Ȼ���й㷺���ڣ��������ԭ���ش��������⣺
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013���¿α���������¿����ģ���ѧ�Ծ���A�������������� ���ͣ�ʵ����
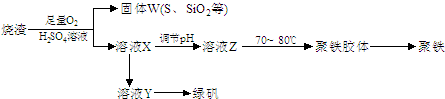
[2012��Ϋ��һģ] ��14�֣���ͭ�����Ҫ�ɷ���CuFeS2���ǹ�ҵ��ͭ����Ҫԭ�ϡ���֪��ͭ���ڿ����б�������Cu��FeS��SO2��FeS+2HCl=FeCl2+H2S����H2S��һ�־綾���塣ij����С������Ի�ͭ��Ϊԭ����ȡ����ͭ���Ȼ�������(FeCl3��6H2O)���������£�

��1��92gCuFeS2�ڿ����б�������Cu��FeS��SO2ת�Ƶ��ӵ����ʵ���Ϊ ��
��2����������������IJ������� ��
��3����ʵ�����У�����38��(�ܶ�Ϊ1.18g��mL-1)����������30�������ᣬ��Ҫ�IJ���������Ҫ�� ��
��4����������ѡ�� (��д���)������Ҫ������ ��
| A��O2 | B��H2 | C��Cl2 | D��N2 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ���¿α���������¿����ģ���ѧ�Ծ���A�����������棩 ���ͣ�ʵ����
[2012��Ϋ��һģ] ��14�֣���ͭ�����Ҫ�ɷ���CuFeS2���ǹ�ҵ��ͭ����Ҫԭ�ϡ���֪��ͭ���ڿ����б�������Cu��FeS��SO2��FeS+2HCl=FeCl2+H2S����H2S��һ�־綾���塣ij����С������Ի�ͭ��Ϊԭ����ȡ����ͭ���Ȼ�������(FeCl3��6H2O)���������£�

��1��92gCuFeS2�ڿ����б�������Cu��FeS��SO2ת�Ƶ��ӵ����ʵ���Ϊ ��
��2����������������IJ������� ��
��3����ʵ�����У�����38��(�ܶ�Ϊ1.18g��mL-1)����������30�������ᣬ��Ҫ�IJ���������Ҫ�� ��
��4����������ѡ�� (��д���)������Ҫ������ ��
A��O2 B��H2 C��Cl2 D��N2
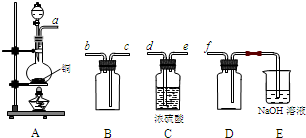
��ѡ������������ʵ��������ȡ��������ĸ����塣

װ��A�з�����Ӧ�����ӷ���ʽΪ ��
ѡ�ú���װ�õ��ܿڵ�����˳��Ϊa�� ��ͼ������G�������� ����ʹ�ø�����ʱ��Ӧ���� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com