
【题目】I.用O2将HCl转化为Cl2,可提高效益,减少污染。传统上该转化通过如图所示的催化剂循环实现,
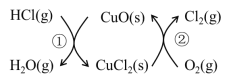
其中,反应①为:2HCl(g) + CuO(s)![]() H2O(g)+CuCl2(s) △H1
H2O(g)+CuCl2(s) △H1
反应②生成1molCl2(g)的反应热为△H2,则总反应的热化学方程式为(反应热用△H1和△H2表示)。
II.氧化锌吸收法常用作脱去冶金工业排放烟气中SO2,其主要步骤如下:配制ZnO悬浊液(含少量MgO、CaO),在吸收塔中封闭循环脱硫,发生的主要反应为ZnO(s) + SO2(g)=ZnSO3(s),试回答下列问题:
(1)生成的ZnSO3可热分解处理,其目的是:①生成的高浓度SO2可以用来制备硫酸;②_______________________;
(2)已知:纯ZnO的悬浮液pH约为6.8。用氧化锌吸收法脱去烟气中SO2的过程中,测得pH、吸收效率η随时间t的变化如图1所示。已知被吸收的SO2为c(SO2)吸,溶液中SO32-、HSO3-、H2SO3所占物质的量之比与pH的关系如图2所示。
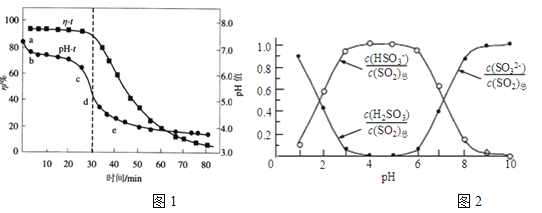
①充分吸收烟气后的混合体系硫元素的主要存在形式是__________________;
②结合图1与图2分析,cd段发生的主要反应是__________________;
③分析图1,ab段的pH迅速下降至6.8左右的原因是______________________;
④为提高SO2的吸收效率η,可采取的措施为___________。
A.增大悬浊液中ZnO的量
B.适当提高单位时间内烟气的循环次数
C.调节溶液的pH至6.0以下
(3)如用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示。(电极材料为石墨)
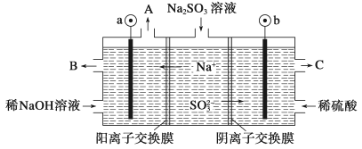
b极的电极反应式为____________________。
【答案】I.2HCl(g)+1/2O2(g)![]() H2O(g)+Cl2(g) △H=△H1+△H2 II.(1)ZnSO3受热分解生成ZnO可以循环利用 ;(2)①HSO3- ;②ZnSO3+SO2+H2O=Zn(HSO3)2 ;③ZnO悬浊液含有的少量MgO、CaO在水中溶解度较ZnO大,ab段MgO、CaO吸收SO2; ④AB;(3)SO32- -2e-+H2O=SO42-+2H+。
H2O(g)+Cl2(g) △H=△H1+△H2 II.(1)ZnSO3受热分解生成ZnO可以循环利用 ;(2)①HSO3- ;②ZnSO3+SO2+H2O=Zn(HSO3)2 ;③ZnO悬浊液含有的少量MgO、CaO在水中溶解度较ZnO大,ab段MgO、CaO吸收SO2; ④AB;(3)SO32- -2e-+H2O=SO42-+2H+。
【解析】
试题分析:I.①2HCl(g)+CuO(s) ![]() H2O(g)+CuCl2(s) △H1,②2CuCl2(s)+O2(g)
H2O(g)+CuCl2(s) △H1,②2CuCl2(s)+O2(g) ![]() 2CuO(s)+2Cl2↑(g) 2△H2, ①×2+②,得出4HCl(g)+O2(g)
2CuO(s)+2Cl2↑(g) 2△H2, ①×2+②,得出4HCl(g)+O2(g) ![]() 2H2O(g)+2Cl2(g) △H=2△H1+△H2;II.(1)ZnSO3分解的反应方程式为ZnSO3
2H2O(g)+2Cl2(g) △H=2△H1+△H2;II.(1)ZnSO3分解的反应方程式为ZnSO3![]() ZnO+SO2↑,SO2浓度高,用来制取硫酸,根据流程,ZnO可以循环使用;
ZnO+SO2↑,SO2浓度高,用来制取硫酸,根据流程,ZnO可以循环使用;
(2)①根据图2,当pH=6.8时,硫元素的主要存在形式是HSO3-;②根据图1,cd段对应的pH,根据图2,硫元素以HSO3-为主,因此发生的反应是ZnSO3+SO2+H2O=Zn(HSO3)2;③纯ZnO的悬浮液的pH约为6.8,而配制ZnO的悬浊液中含有少量MgO和CaO,而CaO与水生成Ca(OH)2,Ca(OH)2属于强碱,ab段Ca(OH)2吸收SO2;④A、增大悬浊液中ZnO的量,增加SO2跟ZnO接触面积,能够提高吸收率,故正确;B、适当提高单位时间内烟气的循环次数,能够增加SO2的吸收率,故正确;C、调节pH至6.0以下,溶液酸性,不利于SO2的吸收,故错误;
(3)根据SO32-移动的方向,以及实验的目的,为了得到H2SO4,S的化合价升高,即b为阳极,因此电极反应式为:SO32-+H2O-2e-=SO42-+2H+。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】酯类是工业上重要的有机原料,具有广泛用途。
乙酸苯甲酯(![]() )对花香和果香的香韵具有提升作用,故常用于化妆品和食品工业。乙酸苯甲酯的合成路线如下:
)对花香和果香的香韵具有提升作用,故常用于化妆品和食品工业。乙酸苯甲酯的合成路线如下:
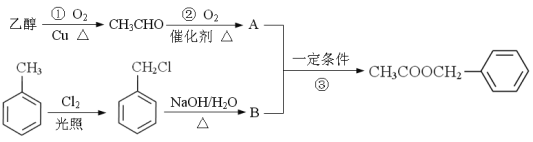
已知:R-Cl![]() R-OH , R- 为烃基)
R-OH , R- 为烃基)
(1)A的结构简式为 ,B所含官能团的名称是 ;
反应③的类型是 。
(2)下列物质中能与A的水溶液反应的是 。(填序号)
A.CaCO3 B.NaOH C.CuSO4 D.NaCl E.Zn
任写一个以上能与A的水溶液反应的化学方程式 。
![]() (3)下列转化中 (填序号)原子的理论利用率为100%,符合绿色化学的要求。
(3)下列转化中 (填序号)原子的理论利用率为100%,符合绿色化学的要求。
A.乙醇制取乙醛
B.由![]() 制备
制备
C.2CH3CHO + O2![]() 2A
2A
(4)写出反应①的化学反应方程式 。
反应①的反应类型是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.任何化学反应都伴随着能量的变化
B.H2O(g)―→H2O(l)该过程放出大量的热,所以该过程是化学变化
C.化学反应中能量的变化一定都表现为热量的变化
D.氢氧化钡晶体和氯化铵晶体的反应属于放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 热的纯碱溶液比冷的纯碱溶液去油污效果好
B. 盛放Na2CO3溶液的试剂瓶不能用橡胶塞
C. 将AlCl3溶液加热、蒸干、灼烧,可得到固体Al2O3
D. 铁在潮湿的环境下生锈与盐类水解无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )。
A. 原子半径大小:Ca>S
B. 金属性强弱:Na<Mg
C. 酸性强弱:HBrO4>HClO4
D. 碱性强弱:NaOH> KOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有Na+、K+、NH4+、Mg2+、Cu2+、SO42-、SO32-、Cl-、Br-、CO32-中的若干种,离子浓度都为0.1mol·L-1。往该溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成。某同学另取少量原溶液,设计并完成如下实验:

则关于原溶液的判断中正确的是
A. 若步骤中Ba(NO3)2和HNO3溶液改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响
B. 无法确定原溶液中是否存在Cl-
C. 肯定存在的离子是SO32-、Br-,是否存在Na+、K+需要通过焰色反应来确定
D. 肯定不存在的离子是Mg2+、Cu2+、SO42-、CO32-,是否含NH4+另需实验验证
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关气体摩尔体积的描述中正确的是( )
A. 相同物质的量的气体摩尔体积一定相同
B. 通常状况下的气体摩尔体积约为22.4L
C. 标准状况下的气体摩尔体积约为22.4L
D. 单位物质的量的气体所占的体积就是气体摩尔体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:
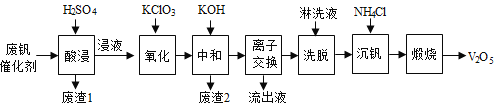
回答下列问题:
(1)“酸浸”时V2O5转化为VO2+,反应的离子方程式为________________________,同时V2O4转成VO2+。“废渣1”的主要成分是__________________。
(2)“氧化”中欲使3 mol的VO2+变为VO2+,则需要氧化剂KClO3至少为_____________mol。
(3)“中和”作用之一是使钒以V4O124形式存在于溶液中。“废渣2”中含有______________。
(4)“离子交换”和“洗脱”可简单表示为:4ROH+ V4O124![]() R4V4O12+4OH(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_____性(填“酸”、“碱”或“中”)。
R4V4O12+4OH(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_____性(填“酸”、“碱”或“中”)。
(5)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物F(C21H20O6)在临床医学上具有预防肿瘤的作用,其合成路线如下:其中反应③中反应物的原子利用率为100%。
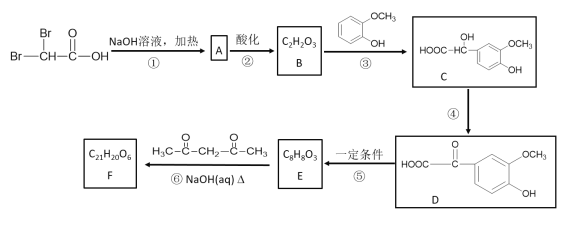
已知:
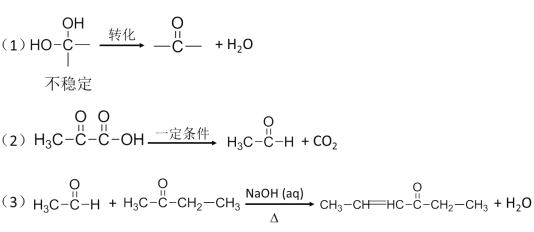
请回答下列问题:
(1)B中含有的官能团名称是___________。③的反应类型为__________。
(2)反应①的化学方程式是________________。反应④的化学方程式是___________。
(3)E的结构简式是______________。F的结构简式是__________________。
(4)E的同分异构体中,同时符合下列两个条件的共有种,其中核磁共振氢谱中有4组吸收峰的同分异构体的结构简式为______________。
①苯环上的一取代物只有2种;
②1 mol该物质与足量NaOH溶液反应时,反应消耗3 mol NaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com