
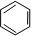
 ��һ�ֳ��������ĺ��������
��һ�ֳ��������ĺ��������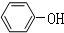 ��
��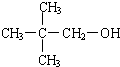 ��
��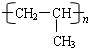 ��
�� ���� ��1��ȼ�պ�����CO2��H2O�����ʵ���֮��Ϊ2����N��C����N��H��=1��1����������Ȳ���������ӵȣ�
��2��ȼ�պ�����H2O��CO2�����ʵ���֮��Ϊ2����N��C����N��H��=1��4��
��3��������ˮ����ϩ����˵���ǻ���λ����ԭ�ӣ�
��4����ȩ�������������ᣬ�Ҷ�ȩ�ɼӳ������Ҷ�����
��5������Ϊ��ȩ����ϩ����̼̼˫�����ɷ����Ӿ۷�Ӧ��
��� �⣺��1��ȼ�պ�����CO2��H2O�����ʵ���֮��Ϊ2����N��C����N��H��=1��1����������Ȳ���������ӵȣ��ṹ��ʽ�ֱ�ΪHC��CH�� ��
��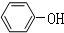 ��
��
�ʴ�Ϊ��HC��CH�� ��
�� 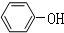 ��
��
��2��ȼ�պ�����H2O��CO2�����ʵ���֮��Ϊ2����N��C����N��H��=1��4��ӦΪCH4���ʴ�Ϊ��CH4��
��3��������ˮ����ϩ����˵���ǻ���λ����ԭ�ӣ�̼ԭ����С��6�����ֱ���һԪ����CH3OH�� ��
��
�ʴ�Ϊ��CH3OH�� ��
��
��4��CH3CHO�������������ᣬOHC-CHO�ɼӳ������Ҷ������ʴ�Ϊ��CH3CHO�� OHC-CHO��
��5���ɽṹ��ʽ��֪Ϊ��ȩ�ļӾ۲����ϩ����̼̼˫�����ɷ����Ӿ۷�Ӧ������Ϊ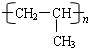 ��
��
�ʴ�Ϊ��HCHO�� 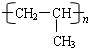 ��
��
���� ���⿼���л���Ľṹ�����ʣ�Ϊ��Ƶ���㣬������ѧ���ķ��������Ŀ��飬ע������л��������ص�����ŵ����ʣ��ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2.3 g Na������O2��ȼ�գ�ת�Ƶĵ�����Ϊ0.1NA | |
| B�� | ��״���£�5.6 L NHs�к��е���ԭ����ĿΪ0.75NA | |
| C�� | 1 L 0.1 mol/LH3PO4��Һ�к��е�������ĿΪ0.4NA | |
| D�� | 1��CO2���ӵ�����Ϊ$\frac{44}{{N}_{A}}$g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����������Ϊ1��ԭ�Ӷ�Ϊ����Ԫ�ص�ԭ�� | |
| B�� | ����������Ϊ8������ϡ������Ԫ�ص�ԭ�� | |
| C�� | ��Ԫ�����ڱ��Ԫ�����ڵ�����������ԭ�Ӻ�����Ӳ��� | |
| D�� | ��Ԫ�����ڱ������Ԫ�����ڵ������������ԭ�Ӻ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | c��Na+����c��SO32-����2��1 | |
| B�� | c��Na+��=2 c��SO32-��+c��HSO3-��+c��H2SO3�� | |
| C�� | c��Na+��+c��H+��=2 c��SO32-��+2 c��HSO3-��+c��OH-�� | |
| D�� | ��������NaOH���壬c��SO32-�� ��c��Na+�� ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����۵������Ҫ�� | |
| B�� | ����ͨ�����Ϸ�Ӧ�Ƶ�FeC12 | |
| C�� | �ؿ��к����������ߣ������ҹ�ʹ������������ʷ�ƾ� | |
| D�� | Fe3O4�ȿ���������������Ӧ�IJ���Ҳ����������ˮ������Ӧ�IJ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ⶨ�䵼��������ͬ | |
| B�� | ��������п�۷�Ӧ����ʼ������ͬ | |
| C�� | ��������п�۷�Ӧ���������������Ϊ1��1��100 | |
| D�� | ��ͬŨ������������Һ��Ӧ����������������Һ�����Ϊ1��2��100 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com