
| 滴定次数 | 待测液体积(mL) | 标准酸液的体积 | |
| 滴定前刻度(mL) | 滴定后刻度(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
| c(标)×V(标) |
| V(待) |
| c(标)×V(标) |
| V(待) |
| c(标)×V(标) |
| V(待) |
| c(标)×V(标) |
| V(待) |
| c(标)×V(标) |
| V(待) |


科目:高中化学 来源: 题型:
| A、常温常压下,1 mol NO2中含有的分子数为 NA |
| B、常温常压下,0.2mol铁在0.2 mol氯气中充分燃烧,转移的电子数为 0.6NA |
| C、7.8g过氧化钠粉末与足量二氧化硫反应转移的电子数为0.2NA |
| D、11.2L Cl2通入足量氢氧化钠溶液中充分反应,转移的电子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有①②③ | B、只有①②④ |
| C、只有③⑤ | D、只有②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
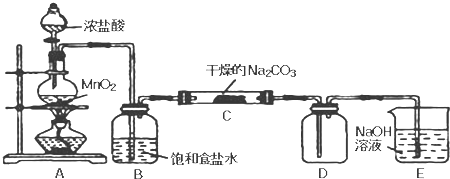
| 实 验 步 骤 | 预 期 现 象 和 结 论 |
| 步骤1:取C中的少量固体样品于试管中,加入蒸馏水至固体溶解,然后各取1~2mL所得溶液分别置于 甲、乙两支试管中. | 得到无色溶液 |
| 步骤2:向甲试管中加入过量的BaCl2溶液,静置. | 若溶液变浑浊,证明固体中含有 |
| 步骤3:取甲试管中上层清液少许于另一只试管中, 滴加少量 | 若 证明固体中含有NaHCO3. |
| 步骤4:向乙试管中 | 若 证明固体中含有 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

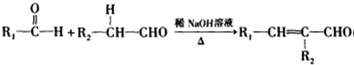 (R1、R2为烃基或氢原子);
(R1、R2为烃基或氢原子); (R1、R2为烃基)
(R1、R2为烃基)查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
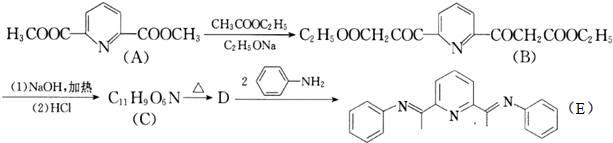
 )且环上只有2个取代基;
)且环上只有2个取代基;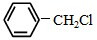 和
和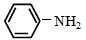 为原料合成西佛碱N-苯基苯甲亚胺(
为原料合成西佛碱N-苯基苯甲亚胺(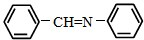 ),请你拟出合成路线:
),请你拟出合成路线:查看答案和解析>>
科目:高中化学 来源: 题型:

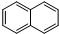 )的衍生物;
)的衍生物;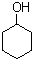 为原料制备化合物B的合成路线流程图(无机试剂任选).合成路线流程图示例如下:H2C═CH2
为原料制备化合物B的合成路线流程图(无机试剂任选).合成路线流程图示例如下:H2C═CH2| HBr |
| NaOH溶液 |
| △ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com