
| A�� | ԭ��Һ�п��ܺ���K+��һ��û��HCO3-��OH-������������ɫ����ͨ�����ʯ��ˮ�У�����ʯ��ˮ����� | |
| B�� | ԭ��Һ��һ������Cl-��NO3-�����ܺ���SO42-����Ӧ���ɵ���ɫ���������������ɫ | |
| C�� | ԭ��Һ��������������ΪMg2+��Fe2+������ϡ�����������ķ�ӦΪ3Fe2++4H++NO3-�T3Fe3++NO��+2H2O | |
| D�� | ����ԭ��Һ�м������NaOH��Һ�������ó������ˡ�ϴ�ӡ����յ����أ��õ��Ĺ�������Ϊ107 g |
���� ��ԭ��Һ�м���ϡ���ᣬ����ɫ�������ɣ���Һ������������䣬����Һ�к���HCO3-��CO32-�������������Һ���������������٣�������Һ�к���Fe2+��NO3-��Cl-������OH-��HCO3-��CO32-��5�������京����Ϊ1mol�������������������������ȣ�ֻ��Mg2+��SO42-���ʣ��Դ˽����⣮
��� �⣺A����Һ�к���Fe2+��NO3-��Cl-�����������������ΪNO�������ʯ��ˮ����Ӧ����A����
B�������Ϸ�����֪һ������SO42-����B����
C����Һ�к���Fe2+��NO3-���������ᷢ��������ԭ��Ӧ���������ķ�ӦΪ3Fe2++4H++NO3-�T3Fe3++NO��+2H2O����C��ȷ��
D������ԭ��Һ�м������NaOH��Һ�������ó������ˡ�ϴ�ӡ����յ����أ��õ��Ĺ���ΪFe2O3��MgO�����ʵ����ֱ�Ϊ0.5mol��1mol������Ϊ120g����D����
��ѡC��
���� ������Ҫ������dz��������ӵļ��顢���ӹ���ȣ�Ϊ��Ƶ���㣬������ѧ���ķ�����ʵ��ͼ��������Ŀ��飬�ۺ��Խ�ǿ���Ѷ��еȣ��״���ΪD��ע�ⲻҪ����MgO��


 һŵ��ҵ�����ҵ���ּ�����������������ϵ�д�
һŵ��ҵ�����ҵ���ּ�����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  �ռ� �ռ� | B�� |  ���� | C�� |  �ƾ� | D�� |  þ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NaOH | B�� | Na2CO3 | C�� | Ca��OH��2 | D�� | NaCl |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
| ������ | �� | �� | �� |
| ���Ԫ�� | B��C | A��C | C��D |
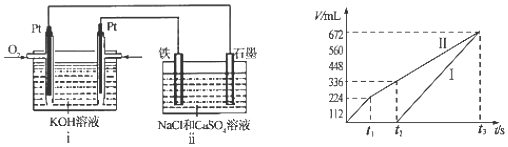
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | KClO3�TK++3O2-+Cl5+ | B�� | NaHCO3�TNa++H++CO32- | ||
| C�� | NaHS?Na++HS- | D�� | HCO3-?H++CO32- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
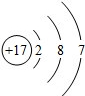 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
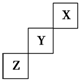
| A�� | X��Y��Z����Ԫ���У���H2������������XԪ�� | |
| B�� | ����������Ӧ��ˮ��������ԣ�Y��Z | |
| C�� | Y����������ϼ�Ϊ+7�� | |
| D�� | X���ʵ��۵��Z�ĵ� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com