
【题目】(1)2.4gRSO4中含0.02molR2+,则RSO4的摩尔质量是____;R的相对原子质量约是___。
(2)除去下列物质中所混有的少量杂质,指明应加入的试剂,写出有关的离子方程式。
NaHCO3溶液(Na2CO3):试剂_________,离子方程式:___________。
(3)实验室需要0.1mol/L的硫酸980mL,欲用密度为1.84g/cm3、溶质的质量分数为98%的浓硫酸进行配制,则需用量筒量取______mL进行配制。假如其他操作均准确无误,若使用量筒量取时俯视读数,最终所配溶液的浓度________(选填“偏高”、“偏低”或“无影响”);若溶解时未冷却,直接转移到容量瓶中至刻度线,最终所配溶液的浓度_________(选填“偏高”、“偏低”或“无影响”)。
(4)实验室在制备Fe(OH)2时必须隔绝空气,否则发生的现象是__。反应化学方程式为___。
【答案】120g/mol 24 CO2 CO2 +![]() +H2O═2
+H2O═2![]() 5.4 mL, 偏低 偏高 白色沉淀迅速变成灰绿色,最终变成红褐色 4Fe(OH)2+O2+2H2O=4Fe(OH)3
5.4 mL, 偏低 偏高 白色沉淀迅速变成灰绿色,最终变成红褐色 4Fe(OH)2+O2+2H2O=4Fe(OH)3
【解析】
(1)2.4gRSO4中含0.02molR2+, ![]() ,
,![]() ,RSO4的摩尔质量是120g/mol;R的相对原子质量约是120-96=24;
,RSO4的摩尔质量是120g/mol;R的相对原子质量约是120-96=24;
(2) Na2CO3 能与CO2、水反应生成NaHCO3,所以用CO2 除去NaHCO3溶液混有的Na2CO3,离子方程式为:CO2 +![]() +H2O═2
+H2O═2![]() ;
;
(3) 浓硫酸的物质的量浓度 ![]() ,由于实验室无980mL容量瓶,故应选用1000mL容量瓶,所以实际配制的是1000mL溶液,设所需的浓硫酸的体积为VmL,根据稀释公式:c浓V浓=c稀V稀,可知:18.4mol/L×VmL=0.1mol/L×1000mL,可求得V=5.4,所以需用量筒量取5.4mL进行配制;用量筒量取时俯视读数,使得浓硫酸的体积达不到5.4mL,即溶质物质的量偏少,根据
,由于实验室无980mL容量瓶,故应选用1000mL容量瓶,所以实际配制的是1000mL溶液,设所需的浓硫酸的体积为VmL,根据稀释公式:c浓V浓=c稀V稀,可知:18.4mol/L×VmL=0.1mol/L×1000mL,可求得V=5.4,所以需用量筒量取5.4mL进行配制;用量筒量取时俯视读数,使得浓硫酸的体积达不到5.4mL,即溶质物质的量偏少,根据![]() ,则最终所配溶液的浓度偏低;若溶解时未冷却,则冷却后体积会减小,根据
,则最终所配溶液的浓度偏低;若溶解时未冷却,则冷却后体积会减小,根据![]() ,体积减小得浓度偏高;
,体积减小得浓度偏高;
(4) Fe(OH)2易被空气中的氧气氧化为红褐色的Fe(OH)3,现象是:白色沉淀迅速变成灰绿色,最终变成红褐色;反应化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3。


科目:高中化学 来源: 题型:
【题目】乙酸乙酯广泛用于药物、染料、香料等工业,某学习小组设计以下两套装置用乙醇、乙酸和浓硫酸分别制备乙酸乙酯(沸点77.2℃)。下列说法不正确的是
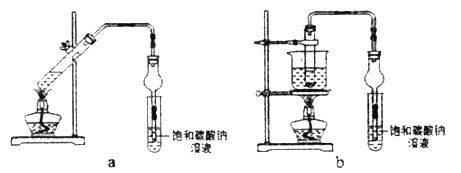
A. 浓硫酸能加快酯化反应速率 B. 不断蒸出酯,会降低其产率
C. 装置b比装置a原料损失的少 D. 可用分液的方法分离出乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是常用的氧化剂。某化学小组在实验室以软锰矿(主要成分是MnO2)为原料制备KMnO4,下图是实验室制备高锰酸钾的操作流程。

已知:
温度 | 溶解度/g | ||
K2CO3 | KHCO3 | KMnO4 | |
20℃ | 111 | 33.7 | 6.38 |
请回答:
(1) 反应①的化学方程式为______________________________________,加热软锰矿、KClO3和KOH固体,除三脚架、玻璃棒、泥三角和铁坩埚外,还用到的仪器有___,不采用瓷坩埚而选用铁坩埚的理由是______________
(2) 反应②中氧化产物与还原产物的物质的量之比为___________________;上述流程中可以循环利用的物质是__________________________。
(3) 实验时,从滤液中得到KMnO4晶体的实验操作a为___________________,若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低其原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共2.88g,经如下处理:

下列说法正确的是
A.滤液A中的阳离子为Fe2+、Fe3+、H+B.V=224
C.样品中CuO的质量为2.0gD.样品中铁元素的质量为0.56g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一定量含有Na2O杂质的Na2O2试样,用下图的实验装置测定Na2O2试样的纯度(通过CO2与样品反应后生成O2的量测定Na2O2的含量)。(可供选用的反应物只有CaCO3固体、6 mol/L盐酸、6 mol/L硫酸和蒸馏水)
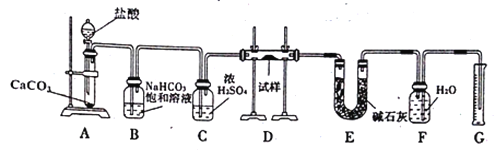
回答下列问题:
(1)实验前必须先_______________________________________________。
(2)装置B的作用是_____________;装置E的作用是______________;
(3)装置D中发生氧化还原反应的化学方程式是:__________________。
(4)若开始时测得样品的质量为2.0g,反应结束后测得气体体积为224mL(标准状况),则Na2O2试样的纯度为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏伽德罗常数,下列叙述错误的是( )
A. 18g H2O中含的质子数为10NA
B. 1mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子
C. 46g NO2和N2O4混合气体中含有原子总数为3NA
D. 12g金刚石含有的共价键数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语表示正确的是( )
A.乙醛分子的比例模型: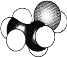
B.中子数为16的硫原子:![]() S
S
C.HCl的电子式:![]()
D.甲酸甲酯的结构简式:HCOOCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年11月4日凌晨,福建泉州泉港区发生“碳九”泄露,对海洋环境造成污染,危害人类健康。“碳九”芳烃主要成分包含![]() (a)、
(a)、![]() (b)、
(b)、![]() (c)等,下列有关三种上述物质说法错误的是
(c)等,下列有关三种上述物质说法错误的是
A. a、b、c互为同分异构体 B. a、b、c均能与酸性高锰酸钾溶液反应
C. a中所有碳原子处于同一平面 D. 1molb最多能与4molH2发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体经历下列过程(Fe3+在pH=5时已完全沉淀),下列分析正确的是
![]()
A. 用98%的浓硫酸配制4.5 mol·L—1稀硫酸,只需3种玻璃仪器
B. 步骤②目的是将溶液Ⅰ中的Fe2+氧化成Fe3+,操作是通入足量的氯气
C. 用Cu(OH)2 替代CuO也可调节溶液pH而不影响实验结果
D. 操作⑤是蒸发结晶,所需仪器是蒸发皿、玻璃棒、酒精灯、泥三角、三脚架
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com