
Na2CO3是一种重要的化工原料,某学生甲拟在实验室中测量Na2CO3的纯度。他利用图1中给出的仪器设计了如图2所示的装置(本题装置图中所用塞子均未画出;杂质不参与反应),其中M容器中盛有Na2CO3样品10.0 g,分液漏斗盛有稀硫酸,N容器内为碱石灰固体。他利用碱石灰的增重来求算Na2CO3的纯度。


图1 图2
(1)学生乙认为,按学生甲设计的装置进行实验,存在明显缺陷,其中导致测定结果偏低的是__________。
(2)学生乙对学生甲设计的实验装置进行了完善(如图3)。实验室中可供选择的药品:Zn、浓硫酸、稀硫酸、NaOH溶液、碱石灰、CaCO3、水。请回答下列问题:

图3
①B、D虚框内是否需要添加装置,若需要,在相应虚框内画出装置图(并注明药品);若不需要,在相应虚框内打“×”;
②A装置中分液漏斗内液体为__________;U形管内药品为__________;装置F的作用为__________;
③如果B、D内部不设计任何装置而直接连通ACE,则实验结果将__________(填“偏高”“偏低”或“无影响”);
④如果实验后E装置质量增重3.96 g,则该Na2CO3试样的纯度为__________。
(1)M中残留CO2未能被吸收
(2)①
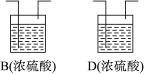
②稀硫酸 Zn 吸收空气中CO2和水蒸气 ③偏高 ④95.4%
(1)甲同学设计装置明显缺陷为CO2不能完全被碱石灰吸收,故残留在M中的CO2不能被吸收,可导致测定结果偏低。
(2)②A装置作用为产生H2,从而将C中CO2排入E被吸收,故A中分液漏斗内液体为稀硫酸,U形管内为Zn。F装置作用为吸收空气中的CO2和水蒸气,防止进入E装置。
③B装置作用为干燥氢气,D装置作用为干燥CO2,若无B、D装置,则E中质量增加偏大,故结果偏大。
④n(CO2)=0.09 mol,m(Na2CO3)=9.54 g,Na2CO3试样纯度为![]() ×100%=95.4%。
×100%=95.4%。


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:阅读理解
| 编号 | V (Na2CO3)/mL | 沉淀情况 |
| 1 | 2.8 | 多、蓝色 |
| 2 | 2.4 | 多、蓝色 |
| 3 | 2.0 | 较多、绿色 |
| 4 | 1.6 | 较少、绿色 |
| 编号 | 反应温度/℃ | 沉淀情况 |
| 1 | 40 | 多、蓝色 |
| 2 | 60 | 少、浅绿色 |
| 3 | 75 | 较多、绿色 |
| 4 | 80 | 较多、绿色(少量褐色) |

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
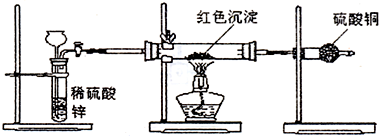
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 温度/℃ | FeSO4?7H2O | (NH4)2SO4 | (NH4)2SO4?FeSO4?6H2O |
| 10 | 20.0 | 73.0 | 17.2 |
| 20 | 26.5 | 75.4 | 21.6 |
| 30 | 32.9 | 78.0 | 28.1 |
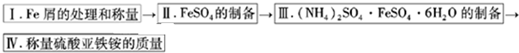
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com