
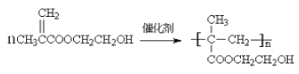
【题目】聚甲基丙烯酸羟乙酯(HEMA)是一种隐形眼镜的仿生材料,其单体的结构简式为:

回答下列问题:
(1)写出合成路线中C4H8的结构简式____________,写出它的系统命名法名称___________。
(2)D分子中含有的官能团名称为___________。
(3)反应②的试剂及条件为___________,反应⑤的反应类型为___________。
(4)写出反应⑥的化学方程式___________。
(5)写出由单体合成聚甲基丙烯酸羟乙酯(HEMA)的化学方程式___________。
(6)写出同时符合下列条件的C的同分异构体:___________。
①能与NaHCO3溶液反应放出气体 ②核磁共振氢谱中有3组吸收峰
【答案】![]() 2-甲基丙烯 羟基和羧基 NaOH水溶液加热 消去反应
2-甲基丙烯 羟基和羧基 NaOH水溶液加热 消去反应 
![]()
【解析】
由逆合成法可知,E与环氧乙烷发生加成反应生成![]() ,结合E的分子式可知E为CH2=C(CH3)COOH,结合流程可知,碳链骨架不变、碳原子数不变,C4H8为CH2=C(CH3)2,与溴加成生成A为BrCH2CBr(CH3)2,B氧化生成C、C氧化生成D,可知A发生水解生成B为HOCH2C(OH)(CH3)2,B氧化生成C为(CH3)2C(OH)CHO,C氧化生成D为(CH3)2C(OH)COOH,D发生消去反应生成E,以此来解答。
,结合E的分子式可知E为CH2=C(CH3)COOH,结合流程可知,碳链骨架不变、碳原子数不变,C4H8为CH2=C(CH3)2,与溴加成生成A为BrCH2CBr(CH3)2,B氧化生成C、C氧化生成D,可知A发生水解生成B为HOCH2C(OH)(CH3)2,B氧化生成C为(CH3)2C(OH)CHO,C氧化生成D为(CH3)2C(OH)COOH,D发生消去反应生成E,以此来解答。
(1)根据图示可知:合成路线中C4H8的结构简式为CH2=C(CH3)2,它的系统命名法名称为2-甲基丙烯;
(2)根据前面分析可知D为D为(CH3)2C(OH)COOH,在D分子中含有的官能团名称为羟基、羧基;
(3)反应②是A为卤代烃BrCH2CBr(CH3)2在NaOH的水溶液中,在加热条件下发生水解反应产生HOCH2C(OH)(CH3)2,②试剂及条件为NaOH水溶液、加热;反应⑤是D物质(CH3)2C(OH)COOH在浓硫酸存在时,在加热条件下发生消去反应形成E:CH2=C(CH3)COOH,故反应类型为消去反应;
(4)反应⑥是![]() 与
与![]() 发生反应生成
发生反应生成![]() ,反应的化学方程式为
,反应的化学方程式为![]() ,
,
(5)由单体![]() 在一定条件下发生加聚反应合成聚甲基丙烯酸羟乙酯(HEMA)的化学方程式为
在一定条件下发生加聚反应合成聚甲基丙烯酸羟乙酯(HEMA)的化学方程式为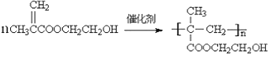 ;
;
(6)物质C结构简式为(CH3)2C(OH)CHO,同时符合下列条件的C的同分异构体:①能与 NaHCO3溶液反应放出气体,说明分子中含-COOH;②该同分异构体的核磁共振氢谱中有3组吸收峰,说明分子中含3种不同的H原子,则符合条件的结构简是![]() 。
。


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】我国规定:室内甲醛含量不得超过0.08mg·m-3。某研究性学习小组欲利酸性KMnO4溶液测定空气中甲醛的含量, (部分装置如图),其反应原理及步骤如下:
4MnO4-+5HCHO+H +=Mn2++5CO2↑+11H2O
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O

步骤:①量取5.00mL 1.00×10-3mol·L-1 KMnO4,溶液于洗气瓶中,并滴入几滴稀H2SO4,加水20mL稀释备用。
②取1.00×10-3mol·L-1草酸标准溶液于酸式滴定管中备用。
③用注射器抽取100mL新装修室内空气。再将注射器气体推入洗气瓶中充分反应。再重复4次。
④将洗气瓶中溶液转移到锥形瓶中(包括洗涤液),再用标准草酸溶液进行滴定,记录滴定所消耗的草酸溶液的体积。
⑤再重复实验2次(每次取高锰酸钾溶液5.00mL)。3次实验消耗草酸溶液的体积平均值为12.38mL。
回答下列问题
(1)此实验用指示剂____________(填字母)。A 甲基橙 b酚酞 c淀粉 d无需另外添加试剂
(2)量取5.00mL KMnO4溶液应用______________滴定管
(3)下列操作能引起室内甲醛浓度偏高的是________。
a.滴定终点俯视读数 b.滴定前有气泡滴定后无气泡
c.在高锰酸钾溶液中加入少量水 d.装草酸的滴定管未润洗
(4)草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,如果向10 mL 0.01 molL-1 H2C2O4溶液中滴加0.0 1 molL-1 NaOH溶液
①当加入的NaOH溶液体积为10 mL,请你写出溶液中质子守恒关系式__________。
②当加入的NaOH溶液体积为20 mL,请你写出溶液中离子的浓度大小关系__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[物质结构与性质一选修3]
种类繁多的碳族元素的单质及其化合物,有着重要的研究价值。
(1)锗(Ge)的含量十分稀少,但它被广泛应用于电子、光学、化工、生物医学、能源及其他高新科技领域。
①现代化学中,常利用__________上的特征谱线来鉴定元素。基态锗原子中,核外能级最高的原子轨道上,具有的电子数为___________。
②通常状况下GeCl4是无色液体,易挥发,其熔点为-51.50C,沸点为86.55℃,能溶于乙醚。由此可推知GeCl4应属于共价化合物,其理由是_______,也即氯和锗两元素的电负性相差应该_______1.7(填“小于”或“大于”)。
(2)在硅酸盐中,![]() 如图a所示为四面体结构,它可以通过公用顶角0原子,形成链状层状、岛状和网状结构的不同硅酸盐。图b表示由n个四面体连接成的硅酸根,其中Si的杂化形式为_____,Si与O的原子个数比为________,化学式可表示为__________。
如图a所示为四面体结构,它可以通过公用顶角0原子,形成链状层状、岛状和网状结构的不同硅酸盐。图b表示由n个四面体连接成的硅酸根,其中Si的杂化形式为_____,Si与O的原子个数比为________,化学式可表示为__________。

(3)石墨晶体由层状石墨“分子”按ABAB方式堆积而成,如图(a)所示。图(b)是一个石墨的六方晶胞示意图。

①请在图 中画出晶胞沿c轴的投影 (用“·”标出碳原子位置即可)_________。
中画出晶胞沿c轴的投影 (用“·”标出碳原子位置即可)_________。
②假设石墨晶胞高为h cm,C-C键长为r cm,则石墨晶体密度的表达式为__________g.cm-3(阿伏加德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在10℃时某化学反应速率为0.1mol/ (L·s),若温度每升高10℃反应速率增加到原来的2倍。为了把该反应速率提高到1.6 mol/(L·s),则该反应需在什么温度下进行
A. 30℃ B. 40℃ C. 50℃ D. 60℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为2L的真空密闭容器中加人1 mol CaCO3,发生反应:CaCO3(s) ![]() CaO(s)+CO2(g)。测得二氧化碳的物质的量浓度随温度的变化如图所示。图中曲线A表示CO2的平衡浓度与温度的关系;B是不同温度下,反应经过相同的时间时,CO2物质的量浓度的变化曲线.
CaO(s)+CO2(g)。测得二氧化碳的物质的量浓度随温度的变化如图所示。图中曲线A表示CO2的平衡浓度与温度的关系;B是不同温度下,反应经过相同的时间时,CO2物质的量浓度的变化曲线.

请回答下列问题:
(1)已知:①CaO(s)+SO2(g)==CaSO3(s) △H1=-402kJ·mol-1
②2CaCO3(s)+2SO2(g)+O2(g)==2CaSO4(s)+2CO2(g) △H2=-2762kJ·mol-1
③2CaSO3(s)+O2(g)==2CaSO4(s) △H3=-2315kJ·mol-1
则:CaCO3(s)==CaO(s)+CO2(g)的△H=____kJ·mol-1
(2)①温度为T5℃时,反应CaCO3(s) ![]() CaO(s)十CO2(g)耗时20s达到平衡,则20s内该反应的反应速率为v(CO2)=____;反应的平衡常数为____mol·L-1。
CaO(s)十CO2(g)耗时20s达到平衡,则20s内该反应的反应速率为v(CO2)=____;反应的平衡常数为____mol·L-1。
②如果该反应的平衡常数K值变大,该反应____(选填编号)。
A.一定向逆反应方向移动 B.在平衡移动时正反应速率先增大后减小
C.一定向正反应方向移动 D.在平衡移动时逆反应速率先减小后增大
(3)在T5℃下,维持温度和容器体积不变,充入CO2气体,则达到平衡时CaCO3的质量____(填“增大”、“减小”或“不变”)。
(4)在T5℃下,反应达到平衡状态后,再压缩容器为1L,重新达到平衡时,CO2的浓度____(填“增大”、“减小”或“不变”)
(5)随着温度的升高,曲线B向曲线A逼近的原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验过程中产生的现象与图形相符合的是( )

A. 稀硫酸滴加到Ba(OH)2溶液中(横坐标是稀硫酸的体积,纵坐标为溶液的导电能力)
B. 铁粉加到一定量CuSO4溶液中(横坐标是铁粉的质量,纵坐标为沉淀质量)
C. CO2通入一定量NaOH溶液中(横坐标是CO2的体积,纵坐标为溶液的导电能力)
D. 将HCl气体通入到一定量 NaOH 溶液中(横坐标是HCl气体的体积,纵坐标为溶液的导电能力)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下有①0.112L水;②3.01×1023个氯化氢分子;③13.6 g H2S气体;④0.2 mol氨气,下列对这四种物质的关系由小到大排列正确的是( )
A. 分子数:①③②④B. 密度:④①③②
C. 质量①④③D. 氢原子数:②④③①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲同学设计如下实验方案,以分离KCl和BaCl2的固体混合物,试回答下列问题:
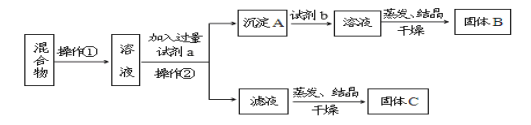
供选择的试剂有:盐酸、硫酸钾溶液、碳酸钾溶液、碳酸钠溶液
(1)操作①的名称是_____,操作②的名称是_____。
(2)试剂a是_____,试剂b是_____,固体B化学式_____。
(3)加入试剂a所发生的化学反应方程式为:____。加入试剂b所发生的化学反应方程式为:___。
(4)乙同学认为该方案不能达到实验目的,理由是:_____ ;应如何改进____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com