
(本题共12分)
沸石是一大类天然结晶硅铝酸盐的统称。自然界中已发现的沸石有30多种,较常见的有方沸石NaAlSi2O6·H2O、钠沸石Na2Al2Si3O10·2H2O和钙沸石CaAl2Si3O10·3H2O等。
完成下列填空:
23.钠原子核外共有 种不同能量的电子,这些电子分占 种不同的轨道。
24.常温下,下列5种钠盐浓度均为0.1mol·L-1的溶液,对应的pH如下:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
23. 4 6 (2分)
24. CO32- > CN- > ClO- > HCO3- > CH3COO-(2分)
25. c(Na+) > c(HCO3-) > c(CO32-) > c(OH-) > c(H+)(2分)
26.高温下能与一些金属氧化物发生铝热反应;常温下遇浓硫酸或浓硝酸产生钝化现象;能与强碱溶液反应生成盐并放出氢气。(3分)
27. 金刚石>金刚砂>晶体硅 (1分)
28. CaO·Al2O3·3SiO2·3H2O (2分)
解析试题分析:23、钠原子核外电子排布为1s22s22p63s1,故有4种能量不同的电子,占据3个s轨道,1个P(有3个轨道)共6个轨道;24、盐类水解越弱越水解,水解程度越大其弱离子结合H+能力越强,故有CO32- > CN- > ClO- > HCO3- > CH3COO-;25、0.3molNaOH溶液吸收0.2molCO2,生成0.1mol的NaHCO3和Na2CO3,溶液中以CO32-第一步电离为主,故有c(Na+) > c(HCO3-) > c(CO32-) > c(OH-) > c(H+);26.高温下能与一些金属氧化物发生铝热反应;常温下遇浓硫酸或浓硝酸产生钝化现象;能与强碱溶液反应生成盐并放出氢气;27、三者为原子晶体,其硬度与键能有关,原子半径小,键长短键能大,硅原子半径大于碳原子,所以有金刚石>金刚砂>晶体硅;28、根据化学式确定元素化合价按顺序写出氧化物
考点:考查物质结构与溶液中浓度关系有关问题。


 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:填空题
短周期元素Q、R、T、W在元素周期表中的位置如下图所示,其中T所处的周期序数与主族序数相等,请回答下列问题: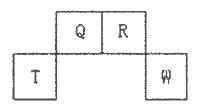
(l)W在周期表中的位置是___________,Q、R、T三种元素原予的半径从大到小排列顺序为 (用元素符号表示),Q的最高价氧化物的电子式___________,R气态氢化物分子的结构式为___________;
(2)元素的原子得电子能力:Q_____W(填“强于”或“弱于”);
(3)原子序数比R多8的元素形成的一种常见气态氢化物的沸点___________(填“高”或“低”)于R的的常见气态氢化物;
(4)T、Q、R、W的单质中,固态时属于原子晶体的是___________(填名称);
(5)现有8种属于短周期的元素,它们的性质、数据如下表所列。请指出R元素在下表中的对应编号___________,与T同周期且最高价氧化物的水化物碱性最强的元素在下表中的对应编号___________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
【选修3-物质结构与性质】(20分)
19-I(6分)对于钠的卤化物(NaX)和硅的卤化物(SiX4),下列叙述正确的是
| A.SiX4难水解 | B.SiX4是共价化合物 |
| C.NaX易水解 | D.NaX的熔点一般高于SiX4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有部分元素的性质与原子(或分子)结构如下表:
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 第3周期元素的简单离子中半径最小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(15分) 已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E。又知A原子的p轨道为半充满,其形成的简单氢化物的沸点是同主族非金属元素的氢化物中最高的。D原子得到一个电子后其3p轨道将全充满。B+离子比D原子形成的离子少一个电子层。C与B可形成BC型的离子化合物。E的原子序数为29。
请回答下列问题:
(1) 元素A简单氢化物中A原子的杂化类型是 ,B、C、D的电负性由小到大的顺序为
__ (用所对应的元素符号表示)。C的气态氢化物易溶于水的原因是 。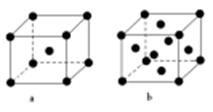
(2)E原子的基态电子排布式为 。元素E的单质晶体在不同温度下可有两种堆积方式,晶胞分别如右图a和b所示,则其面心立方堆积的晶胞与体心立方堆积的晶胞中实际含有的E原子的个数之比为 。
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图所示),其中3种离子晶体的晶格能数据如下表:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(12分)【化学——物质结构与性质】
A、B、C、D、E是原子序数依次增大的五种元素。B元素原子最外层电子数比内层多3个,C、D元素同主族且原子序数D为C的二倍,E元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,回答下列问题。
(1)E元素基态原子的外围电子排布图为_______。
(2)元素B、C、D的第一电离能由小到大排列顺序为_______(用元素符号表示)。
(3) DC3冷凝可形成一种D、C相间的六元环结构的三聚体,其中D原子的杂化方式
为_______。
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和1:2,
两种化合物可任意比互溶,其主要原因是________。
(5)A、B、C、D、E五种元素组成某配位化合物X,其原子个数比为18:6:4:1:1,
该配位化合物X的化学式为_________。
(6) Sb的一种氧化物高于843K时会转化为长链的大分子,
其结构片段如图,则该分子中Sb和O的原子个数比为_______ 。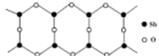
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(15分)
M、N、O、P、Q是元素周期表中原子序数依次递增的前四周期元素。M原子最外层电子数为内层电子数的3倍;N的焰色反应呈黄色;O的氢化物是一种强酸,其浓溶液可与M、Q的化合物反应生成O的单质;P是一种金属元素,其基态原子中有6个未成对电子。请回答下列问题:
(1)元素Q的名称为__________,P的基态原子价层电子排布式为__________ 。
(2)O的氢化物的沸点比其上一周期同族元素的氢化物低,是因为__________________________.
(3)M、O电负性大小顺序是__________(用元素符号表示),O的最高价含氧酸根的空间构型为__________,其中心原子的杂化类型为___________。
(4)M、N形成的化合物的晶胞如图所示,该晶胞的化学式为__________ ,其中M离子的配位数为__________,该晶体类型为___________。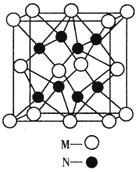
(5)该晶胞的边长为a×10 cm,则距离最近的M、N离子间的距离为
cm,则距离最近的M、N离子间的距离为
__________cm。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(15分)X、Y、Z、W是元素周期表前四周期中的常见元素。其相关信息如下表:
| 元素 | 相关信息 |
| X | X的一种核素的质量数为18,中子数为10 |
| Y | Y与X同主族,且它的一种氧化物是导致酸雨的主要物质之一 |
| Z | Z的单质常温下为黄绿色气体 |
| W | W的基态原子核外有4个未成对电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
M原子在第二能层上只有一个空轨道,则M是 ;其电子排布式为 ;R原子的3p轨道上只有一个未成对电子,则R原子可能是 、 ;Y原子的核电荷数为33,其外围电子排布是 ,其在元素周期表中的位置是 ,是属于 区的元素。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com