
| A、1L 1mol?L-1的NH4Cl溶液中一定含有NA个NH4+ | B、常温常压下,22.4L乙烯中含极性共价键数为5NA | C、6.8g熔融的KHSO4中含有0.05NA个阳离子 | D、1mol冰醋酸和1mol乙醇在浓硫酸加热下反应可生成NA个H2O |


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
| A、②④⑤ | B、①③⑥ | C、①③④ | D、③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、46g NO2和N2O4的混合物中含有的氮原子数为NA | B、常温常压下,22.4L乙烯中含极性共价键数目为5NA | C、1L 0.1mol/L的Fe2(SO4)3溶液中,Fe3+的数目为0.2NA | D、1mol羟基(-OH)中含电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25°C时,pH=12的Ba(OH)2溶液中含有的OH-数目为0.02NA | ||
| B、室温下,14.0g乙烯和丁烯的混合气体中含有的C-H键数目为2.0NA | ||
C、1L 0.5mol?L-1 的(NH4)2SO4溶液中含有的N
| ||
| D、标准状况下,22.4LCCl4中含有的共用电子对数目为4.0NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,2.24L NH3分子中共价键数目为0.3NA | B、1L 1mol?L-1 H2O2溶液中氧原子数目为2NA | C、25℃时,pH=7的纯水中OH-数目为1×10-7NA | D、1L 0.1mol?L-1 NH4Cl溶液中NH4+数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1L 0.1mol?L-1的氨水中有NA个NH4+ | B、常温常压下,8g O2含有4NA个电子 | C、标准状况下,22.4L三氯甲烷含有NA个分子 | D、1mol Na被完全氧化生成Na2O2,失去2NA电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2mol铝与足量烧碱溶液反应时,被还原的水分子数目为2NA | B、常温下,pH=11的氨水中OH-数目为1×10-3NA | C、1mol明矾与水反应完全转化为氢氧化铝胶体后,胶体粒子的数目为NA | D、常温常压下,2gD216O中含中子数、质子数、电子数均为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol Na2CO3?10H2O晶体中,阴离子总数大于0.1NA | B、常温常压下,18mL水中所含氢离子数约为10-7NA | C、标准状态下,22.4L氦气中含有的原子数约为NA | D、23g组成为C2H4O的有机物,C-H键数目为3NA |
查看答案和解析>>
科目:高中化学 来源:2014~2015学年江苏省高二(文)上学期期中化学试卷(解析版) 题型:实验题
(10分)某化学小组欲以CO2主要为原料,采用下图所示装置模拟“侯氏制碱法”制取NaHCO3,并对CO2与NaOH的反应进行探究。请你参与并完成对有关问题的解答。
【资料获悉】
1、“侯氏制碱法”原理:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl,然后再将NaHCO3制成Na2CO3。
2、Na2CO3与盐酸反应是分步进行:Na2CO3先与盐酸反应生成NaHCO3;然后再发生NaHCO3+HCl= NaCl+H2O +CO2↑
【实验设计】
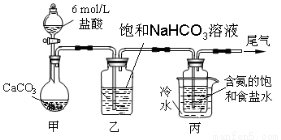
【实验探究】
(1)装置乙的作用是 。
(2)由装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有 、洗涤、灼烧。NaHCO3转化为Na2CO3的化学方程式为 。
(3)若在(2)中灼烧的时间较短,NaHCO3将分解不完全,取加热了t1 min的NaHCO3样品29.6 g完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中有关离子的物质的量的变化如下图所示。
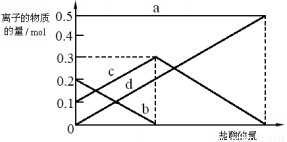
则曲线c对应的溶液中的离子是 (填离子符号);该样品中NaHCO3和Na2CO3的物质的量之比是 。
(4)若将装置甲产生的纯净的CO22.24L(标准状况下)通入100mLNaOH溶液中,充分反应后,将溶液小心蒸干,得到不含结晶水的固体W,其质量为10.16g,则W的成分为 (填化学式),原NaOH溶液的物质的量浓度为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com