
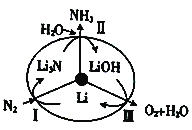
”¾ĢāÄæ”æij»ÆѧæĪĶāŠ”×éÓĆĶ¼ĖłŹ¾×°ÖĆÖĘČ”äå±½£®ĻČĻņ·ÖŅŗĀ©¶·ÖŠ¼ÓČė±½ŗĶŅŗä壬ŌŁ½«»ģŗĻŅŗĀżĀżµĪČė·“Ó¦Ę÷A£ØAĻĀ¶Ė»īČū¹Ų±Õ£©ÖŠ£®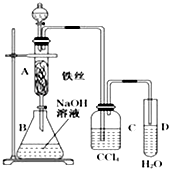
£Ø1£©Š“³öAÖŠ·“Ó¦µÄ»Æѧ·½³ĢŹ½ £®
£Ø2£©AÖŠĢśĖæµÄ×÷ÓĆ £®
£Ø3£©ŹµŃé½įŹųŹ±£¬“ņæŖAĻĀ¶ĖµÄ»īČū£¬ČĆ·“Ó¦ŅŗĮ÷ČėBÖŠ£¬³ä·ÖÕńµ“£¬ÄæµÄŹĒ £¬ Š“³öÓŠ¹ŲµÄ»Æѧ·½³ĢŹ½ £®
£Ø4£©CÖŠŹ¢·ÅCCl4µÄ×÷ÓĆŹĒ £® ČōÖ¤Ć÷±½ŗĶŅŗäå·¢ÉśµÄŹĒČ”“ś·“Ó¦£¬¶ų²»ŹĒ¼Ó³É·“Ó¦£¬æÉĻņŹŌ¹ÜDÖŠ¼ÓČėAgNO3ČÜŅŗ£¬Čō²śÉśµ»ĘÉ«³Įµķ£¬ŌņÄÜÖ¤Ć÷£®ĮķŅ»ÖÖŃéÖ¤µÄ·½·ØŹĒĻņŹŌ¹ÜDÖŠ¼ÓČė £¬ ĻÖĻóŹĒ £®
”¾“š°ø”æ
£Ø1£©C6H6+Br2 ![]() C6H5Br+HBr
C6H5Br+HBr
£Ø2£©×÷“߻ƼĮ
£Ø3£©³żČ„ČÜÓŚäå±½ÖŠµÄä壻Br2+2NaOHØTNaBr+NaBrO+H2O
£Ø4£©³żČ„äå»ÆĒāĘųĢåÖŠµÄäåÕōĘų£»ŹÆČļŹŌŅŗ£»ČÜŅŗ±äŗģÉ«
”¾½āĪö”æ½ā£ŗ£Ø1£©ŌŚ“߻ƼĮµÄ×÷ÓĆĻĀ£¬±½»·ÉĻµÄĒāŌ×Ó±»äåŌ×ÓĖłČ”“ś£¬Éś³Éäå±½£¬Ķ¬Ź±ÓŠäå»ÆĒāÉś³É£ŗ·¢Éś·“Ó¦ĪŖ£ŗC6H6+Br2 ![]() C6H5Br+HBr£¬ĖłŅŌ“š°øŹĒ£ŗC6H6+Br2
C6H5Br+HBr£¬ĖłŅŌ“š°øŹĒ£ŗC6H6+Br2 ![]() C6H5Br+HBr£»£Ø2£©±½ÓėŅŗäå·¢ÉśŌŚĢśĖæ×ö“߻ƼĮĢõ¼žĻĀ·¢ÉśČ”“ś·“Ӧɜ³Éäå±½ŗĶäå»ÆĒā£¬ĖłŅŌ“š°øŹĒ£ŗ×÷“߻ƼĮ£»£Ø3£©ĀČĘųÓėNaOHČÜŅŗµÄ·“Ó¦£ŗCl2+2NaOHØTNaCl+NaClO+H2O£®½«ĘäÖŠµÄ”°Cl”±»»³É”°Br”±¼“µĆBr2ÓėNaOHČÜŅŗ·“Ó¦µÄ»Æѧ·½³ĢŹ½£¬Br2+2NaOHØTNaBr+NaBrO+H2O£¬ÓÉ“ĖæÉÖŖŹµŃé½įŹųŹ±£¬“ņæŖAĻĀ¶ĖµÄ»īČū£¬ČĆ·“Ó¦ŅŗĮ÷ČėBÖŠ£¬³ä·ÖÕńµ“£¬³żČ„ČÜÓŚäå±½ÖŠµÄä壬ĖłŅŌ“š°øŹĒ£ŗ³żČ„ČÜÓŚäå±½ÖŠµÄä壻Br2+2NaOHØTNaBr+NaBrO+H2O£»£Ø4£©CCl4ÄÜČܽāäå²»ÄÜČܽāäå»ÆĒā£¬CÖŠŹ¢·ÅCCl4µÄ×÷ÓĆŹĒ³żČ„äå»ÆĒāĘųĢåÖŠµÄäåÕōĘų£¬Čē¹ū±½ŗĶŅŗäå·¢ÉśµÄŹĒČ”“ś·“Ó¦£¬ŌņÓŠHBrÉś³É£¬Čē¹ū·¢ÉśµÄŹĒ¼Ó³É·“Ó¦£¬ŌņĪŽHBrÉś³É£®Ņ²¾ĶŹĒĖµ£¬Čē¹ūŅŖÖ¤Ć÷±½ŗĶŅŗäå·¢ÉśµÄŹĒČ”“ś·“Ó¦£¬¶ų²»ŹĒ¼Ó³É·“Ó¦£¬Ö»Šč¼ģŃéÓŠĪŽHBrÉś³É£®ĢāÄæŅŃ¾øų³ö¼ģŃéBr©µÄ·½°ø£¬ĪŅĆĒŌŁ»Ų“š³ö¼ģŃéH+µÄ·½·Ø¼“æÉ£®µ«äåŅ×»Ó·¢£¬äå»ÆĒāĘųĢåÖŠµÄäåÕōĘų¶Ōäå»ÆĒāµÄ¼ģŃéÓŠøÉČÅ×÷ÓĆ£¬Ņņ“Ė£¬ŌŚ¼ģŃéäå»ÆĒāĒ°±ŲŠė³żČ„äåÕōĘų£¬ÕāŅ²ÕżŹĒCÖŠŹ¢·ÅµÄCCl4µÄ×÷ÓĆ£® ĖłŅŌ“š°øŹĒ£ŗ³żČ„äå»ÆĒāĘųĢåÖŠµÄäåÕōĘų£»ŹÆČļŹŌŅŗ£»ČÜŅŗ±äŗģÉ«£®
C6H5Br+HBr£»£Ø2£©±½ÓėŅŗäå·¢ÉśŌŚĢśĖæ×ö“߻ƼĮĢõ¼žĻĀ·¢ÉśČ”“ś·“Ӧɜ³Éäå±½ŗĶäå»ÆĒā£¬ĖłŅŌ“š°øŹĒ£ŗ×÷“߻ƼĮ£»£Ø3£©ĀČĘųÓėNaOHČÜŅŗµÄ·“Ó¦£ŗCl2+2NaOHØTNaCl+NaClO+H2O£®½«ĘäÖŠµÄ”°Cl”±»»³É”°Br”±¼“µĆBr2ÓėNaOHČÜŅŗ·“Ó¦µÄ»Æѧ·½³ĢŹ½£¬Br2+2NaOHØTNaBr+NaBrO+H2O£¬ÓÉ“ĖæÉÖŖŹµŃé½įŹųŹ±£¬“ņæŖAĻĀ¶ĖµÄ»īČū£¬ČĆ·“Ó¦ŅŗĮ÷ČėBÖŠ£¬³ä·ÖÕńµ“£¬³żČ„ČÜÓŚäå±½ÖŠµÄä壬ĖłŅŌ“š°øŹĒ£ŗ³żČ„ČÜÓŚäå±½ÖŠµÄä壻Br2+2NaOHØTNaBr+NaBrO+H2O£»£Ø4£©CCl4ÄÜČܽāäå²»ÄÜČܽāäå»ÆĒā£¬CÖŠŹ¢·ÅCCl4µÄ×÷ÓĆŹĒ³żČ„äå»ÆĒāĘųĢåÖŠµÄäåÕōĘų£¬Čē¹ū±½ŗĶŅŗäå·¢ÉśµÄŹĒČ”“ś·“Ó¦£¬ŌņÓŠHBrÉś³É£¬Čē¹ū·¢ÉśµÄŹĒ¼Ó³É·“Ó¦£¬ŌņĪŽHBrÉś³É£®Ņ²¾ĶŹĒĖµ£¬Čē¹ūŅŖÖ¤Ć÷±½ŗĶŅŗäå·¢ÉśµÄŹĒČ”“ś·“Ó¦£¬¶ų²»ŹĒ¼Ó³É·“Ó¦£¬Ö»Šč¼ģŃéÓŠĪŽHBrÉś³É£®ĢāÄæŅŃ¾øų³ö¼ģŃéBr©µÄ·½°ø£¬ĪŅĆĒŌŁ»Ų“š³ö¼ģŃéH+µÄ·½·Ø¼“æÉ£®µ«äåŅ×»Ó·¢£¬äå»ÆĒāĘųĢåÖŠµÄäåÕōĘų¶Ōäå»ÆĒāµÄ¼ģŃéÓŠøÉČÅ×÷ÓĆ£¬Ņņ“Ė£¬ŌŚ¼ģŃéäå»ÆĒāĒ°±ŲŠė³żČ„äåÕōĘų£¬ÕāŅ²ÕżŹĒCÖŠŹ¢·ÅµÄCCl4µÄ×÷ÓĆ£® ĖłŅŌ“š°øŹĒ£ŗ³żČ„äå»ÆĒāĘųĢåÖŠµÄäåÕōĘų£»ŹÆČļŹŌŅŗ£»ČÜŅŗ±äŗģÉ«£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠø÷×éĪ¢Į£ÖŠ£¬ŌŚŅ»¶ØĢõ¼žĻĀ¾łæÉŅŌ×÷Ńõ»Æ¼ĮµÄŹĒ(””””)
A.Fe”¢H2O”¢CO2B.ClO£”¢Cl£”¢Ag£«
C.Cl2”¢HClO”¢MgD.Fe3£«”¢MnO4-”¢NO3-
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻÖÓƶžŃõ»ÆĆĢÓėÅØŃĪĖį·“Ó¦Öʱø“æ¾»øÉŌļµÄĀČĘų£¬ŌŁÓĆĀČĘųÓėĶ·Ū·“Ó¦ÖĘȔɣĮæCuCl2£¬Ęä×°ÖĆČēĻĀ£ŗ

£Ø1£©Š“³ö×°ÖĆAÖŠ·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½_________________________”£
£Ø2£©BÖŠŃ”ÓƵďŌ¼ĮŹĒ±„ŗĶŹ³ŃĪĖ®£¬Ęä×÷ÓĆŹĒ³żČ„Cl2ÖŠ»ģÓŠµÄ__________ŌÓÖŹ£»×°ÖĆEµÄ×÷ÓĆŹĒ___________________”£
£Ø3£©¼“Ź¹A×°ÖĆÖŠµÄMnO2ŗĶD×°ÖĆÖŠµÄCu¶¼ŹĒ×ćĮæµÄ£¬100mL 12mol£ÆLÅØŃĪĖį¾³ä·Ö·“Ó¦ŗóµĆµ½µÄCuCl2Ņ²²»×ć0.3mol£¬ĘäŌŅņŹĒ______________
A.×°ÖĆĀ©Ęų B.A×°ÖĆŌŚ¼ÓČČ¹ż³ĢÖŠŃĪĖįŅ×»Ó·¢
C.CuCl2³±½āĪüĖ® D.A×°ÖĆÖŠ·“Ӧɜ³ÉµÄĖ®ŅŖĻ”ŹĶŃĪĖį£¬Ź£ÓąµÄŃĪĖį²»ŌŁ·“Ó¦
£Ø4£©Ä³ŹµŃ銔×éµÄĶ¬Ń§ÓĆ¾Cl2Ļū¶¾µÄ×ŌĄ“Ė®ÅäÖĘĻĀĮŠČÜŅŗ£ŗ¢ŁKI£»¢ŚAgNO3£»¢ŪAlCl3£»¢ÜFeCl2£»¢ŻĻ”ŃĪĖį£¬·¢ĻÖ²æ·ÖŅ©Ę·±äÖŹ£¬ĖüĆĒŹĒ(ĒėÓĆŠņŗÅ×÷“š)____________________”£
£Ø5£©ĮķŅ»øöŹµŃ銔×éµÄĶ¬Ń§ČĻĪŖSO2ŗĶĀČĖ®¶¼ÓŠĘư׊Ō£¬¶žÕß»ģŗĻŗóµÄĘư׊ŌæĻ¶Ø»įøüĒ攣ĖūĆĒ½«ÖʵƵÄSO2ŗĶCl2°“1£ŗ1Ķ¬Ź±ĶØČėµ½Ę·ŗģČÜŅŗÖŠ£¬½į¹ū·¢ĻÖĶŹÉ«Š§¹ū²¢²»ĻńĻėĻóµÄÄĒŃł”£ĒėÄć·ÖĪöøĆĻÖĻóµÄŌŅņ£ØÓĆ»Æѧ·½³ĢŹ½±ķŹ¾£©_____________________________________”£
£Ø6£©Ņ»¶ØĢõ¼žĻĀ£¬ŌŚŅ»¶ØĮæµÄŹÆ»ŅČéÖŠĶØČėŅ»¶ØĮæµÄĀČĘų£¬¶žÕßĒ”ŗĆĶźČ«·“Ó¦”£Éś³ÉĪļÖŠŗ¬ÓŠČżÖÖŗ¬ĀČŌŖĖŲµÄĄė×Ó£¬ĘäÖŠClO£”¢ClO![]() Į½ÖÖĄė×ÓµÄĪļÖŹµÄĮæ(n)Óė·“Ó¦Ź±¼ä(t)µÄĒśĻßČēĶ¼ĖłŹ¾”£
Į½ÖÖĄė×ÓµÄĪļÖŹµÄĮæ(n)Óė·“Ó¦Ź±¼ä(t)µÄĒśĻßČēĶ¼ĖłŹ¾”£
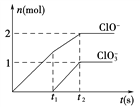
øĆ¹ż³ĢÖŠ²Ī¼Ó·“Ó¦Cl2µÄĪļÖŹµÄĮæŹĒ________mol”£Čō²śÉśµÄn£ØC1-£©ĪŖ11mol£¬n£ØC1O3-£©ĪŖ2 mol£¬Ōņ²Ī¼Ó·“Ó¦µÄCa(OH)2µÄĪļÖŹµÄĮæĪŖ________mol”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĪŖĮĖ³żČ„“ÖŃĪÖŠµÄCa2+”¢Mg2+”¢SO42-¼°ÄąÉ³,æɽ«“ÖŃĪČÜÓŚĖ®,Č»ŗó½ųŠŠĻĀĮŠ²Ł×÷:¢Ł¹żĀĖ,¢Ś¼Ó¹żĮæNaOHČÜŅŗ,¢Ū¼ÓŹŹĮæŃĪĖį,¢Ü¼Ó¹żĮæNa2CO3ČÜŅŗ£¬¢Ż¼Ó¹żĮæBaCl2ČÜŅŗ£¬¢ŽÕō·¢”£ÕżČ·µÄ²Ł×÷Ė³ŠņŹĒ
A.¢Ł¢Ü¢Ś¢Ż¢Ł¢Ū¢ŽB.¢Ł¢Ś¢Ż¢Ü¢Ł¢Ū¢Ž
C.¢Ł¢Ü¢Ś¢Ż¢Ū¢Ł¢ŽD.¢Ł¢Ś¢Ż¢Ü¢Ū¢Ł¢Ž
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¼×»łß»ą«Óė°±ŌŚøßĪĀĻĀ·“Ó¦µĆµ½¼×»łßĮæ©£ŗ
 +H2O
+H2O
£Ø1£©ZnµÄ»łĢ¬Ō×ÓŗĖĶāµē×ÓÅŲ¼Ź½ĪŖ____________”£
£Ø2£©ÅäŗĻĪļ[Zn(NH3)3(H2O)]2£«ÖŠ£¬ÓėZn2£«ŠĪ³ÉÅäĪ»¼üµÄŌ×ÓŹĒ_____________(ĢīŌŖĖŲ·ūŗÅ)”£
£Ø3£©1 mol¼×»łß»ą«·Ö×ÓÖŠŗ¬ÓŠ¦Ņ¼üµÄŹżÄæĪŖ_______________mol”£
£Ø4£©¼×»łßĮæ©·Ö×ÓÖŠĢ¼Ō×Ó¹ģµĄµÄŌӻƹģµĄĄąŠĶŹĒ____________”£ÓėNH3·Ö×Ó»„ĪŖµČµē×ÓĢåµÄŃōĄė×ÓĪŖ________________”£
£Ø5£©¼×»łßĮ橵ÄČŪ·ŠµćøßÓŚ¼×»łß»ą«µÄŌŅņŹĒ________________”£
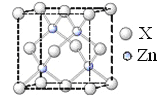
£Ø6£©ŠæµÄijÖÖ»ÆŗĻĪļ¾§°ū½į¹¹ČēĶ¼ĖłŹ¾£¬Ōņ¹¹³ÉøĆ»ÆŗĻĪļµÄĮ½ÖÖĮ£×ÓøöŹż±ČĪŖ_____________
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĘųĢåÖŠµÄÖ÷ŅŖ³É·Ö²»ŹĒ¼×ĶéµÄŹĒ£Ø””””£©
A.æÕĘų
B.ÕÓĘų
C.ĢģČ»Ęų
D.Ė®ĆŗĘų
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠø÷×éĄė×Ó£¬ŌŚÄ³ĪŽÉ«ĶøĆ÷µÄĖįŠŌČÜŅŗÖŠ£¬ÄÜ“óĮæ¹²“ęµÄĄė×Ó×éŹĒ£Ø £©
A.K+”¢Na+”¢SO4”Ŗ”¢HCO3”ŖB.K+”¢Cu2+”¢SO4”Ŗ”¢NO3”Ŗ
C.K+”¢Na+”¢Cl”Ŗ”¢NO3”ŖD.K+”¢Fe3+”¢NO3”Ŗ”¢Cl”Ŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ°±¹ć·ŗÓĆÓŚÉś²ś»Æ·Ź”¢ÖĘĄä¼ĮµČ·½Ćę”£»Ų“šĻĀĮŠĪŹĢā:
£Ø1£©ŹµŃéŹŅæÉÓĆĻĀĶ¼ĖłŹ¾×°ÖĆŗĻ³É°±”£
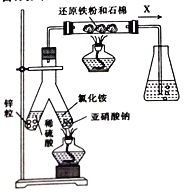
¢ŁŃĒĻõĖįÄĘÓėĀČ»Æļ§·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ_____________________”£
¢Ś×¶ŠĪĘæÖŠŹ¢ÓŠŅ»¶ØĮæĖ®²¢µĪÓŠ¼øµĪ·ÓĢŖŹŌ¼Į”£·“Ó¦Ņ»¶ĪŹ±¼äŗó£¬×¶ŠĪĘæÖŠČÜŅŗ±äŗģ£¬ŌņĘųĢåXµÄ³É·ÖĪŖN2”¢Ė®ÕōĘų”¢_____ŗĶ____(Ģī»ÆѧŹ½)
£Ø2£©×ī½üĖ¹Ģ¹ø£“óѧъ¾æČĖŌ± ·¢Ć÷ ĮĖŅ»ÖÖSUNCATµÄļ®Ń»·ĻµĶ³£¬æɳ֊ųŗĻ³É°±£¬ĘäŌĄķČēĶ¼ĖłŹ¾”£
¢ŁĶ¼ÖŠ·“Ó¦¢ņŹōÓŚ________(Ģī”°Ńõ»Æ»¹Ō·“Ó¦”±»ņ”°·ĒŃõ»Æ»¹Ō·“Ó¦”±)”£
¢Ś·“Ó¦¢óÖŠÄÜĮæ×Ŗ»ÆµÄ·½Ź½ŹĒ________(Ģī”°µēÄÜ×Ŗ±äĪŖ»ÆѧÄÜ”±»ņ”°»ÆѧÄÜ×Ŗ±äĪŖµēÄÜ”±)”£
£Ø3£©Ņŗ°±æÉÓĆ×÷ÖĘĄä¼Į£¬Ņŗ°±Ęų»ÆŹ±________(Ģī”°ŹĶ·Å”±»ņ”°ĪüŹÕ”±)ÄÜĮ棻Ņŗ°±Š¹Ā©ÓöĆ÷»š»į·¢Éś±¬ÕØ”£ŅŃÖŖ²æ·Ö»Æѧ¼üµÄ¼üÄÜŹż¾ŻČēĻĀ±ķĖłŹ¾£ŗ
¹²¼Ū¼ü | N-H | O=O | N”ŌN | O-H |
¼üÄÜ/kJ.mol-1 | 391 | 498 | 946 | 463 |
Ōņ·“Ó¦4NH3(g)+3O2(g)=2N2(g)+6H2O(g)µÄ·“Ó¦ČČ”÷H=__________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠµēĄė·½³ĢŹ½“ķĪóµÄŹĒ
A.CaCl2 £½ Ca2++2Cl-B.Na2SO4 £½ Na22++SO42-
C.HNO3 == H++NO3-D.NaOH £½ Na++OH-
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com