
| A、用酸式滴定管量取0.1000 mol?L-1盐酸时,酸式滴定管经蒸馏水洗净后未用0.1000mo1?L-1盐酸润洗 |
| B、滴定前平视读数,滴定结束时俯视读数 |
| C、滴定前滴定管下端尖嘴没有气泡,滴定后读数时发现滴定管下端尖嘴有气泡 |
| D、用未知浓度的Na0H待测液润洗锥形瓶 |
| c(HCl)×V(HCl) |
| V(NaOH) |
| c(HCl)×V(HCl) |
| V(NaOH) |
| c(HCl)×V(HCl) |
| V(NaOH) |
| c(HCl)×V(HCl) |
| V(NaOH) |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中的c(CH3COO-) |
| B、溶液中的c(H+) |
| C、醋酸的电离平衡常数 |
| D、溶液中的c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
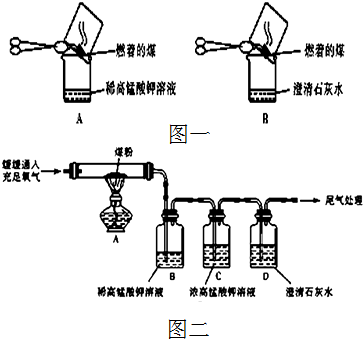
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2mol水的摩尔质量和1 mol水的摩尔质量 |
| B、200mL 1 mol/L氯化钙溶液中c(Cl-)和100 mL 1 mol/L氯化钾溶液中c(Cl-) |
| C、64g二氧化硫中的氧原子数和标准状况下22.4L二氧化碳中的氧原子数 |
| D、2mol/LBa(OH)2溶液中Ba2+的物质的量和OH-的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 颜色、性质 | 物质 | 颜色、性质 | |
| 氢氧化铜Cu(OH)2 | 蓝色固体不溶于水 | 硫酸铜(CuSO4) | 溶液呈蓝色 | |
| 氧化亚铜(Cu2O) | 红色固体不溶于水 | 氯化铜(CuCl2) | 溶液呈绿色,稀溶液呈蓝色 | |
| 氯化亚铜(CuCl) | 白色固体不溶于水 | 碱式氯化铜 | 绿色固体不溶于水 |
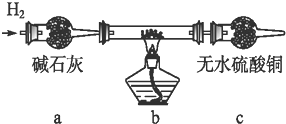 实验结束后,碳棒上的白色物质变为红色,无水硫酸铜不变色.
实验结束后,碳棒上的白色物质变为红色,无水硫酸铜不变色.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com