
Ćŗ»Æ¹¤ÖŠ³£ŠčŃŠ¾æ²»Ķ¬ĪĀ¶ČĻĀĘ½ŗā³£Źż”¢Ķ¶ĮĻ±ČµČĪŹĢā”£
ŅŃÖŖ£ŗCO (g) +H2O (g) H2 (g) +CO2 (g)Ę½ŗā³£ŹżKĖęĪĀ¶ČµÄ±ä»ÆČēĻĀ±ķ£ŗ
H2 (g) +CO2 (g)Ę½ŗā³£ŹżKĖęĪĀ¶ČµÄ±ä»ÆČēĻĀ±ķ£ŗ
»Ų“šĻĀĮŠĪŹĢā
£Ø1£©øĆ·“Ó¦µÄĘ½ŗā³£Źż±ķ“ļŹ½K= £¬¦¤H= 0(Ģī”°<”±”¢”°>”±”¢”°=”±£©
£Ø2£©ŅŃŌŚŅ»¶ØĪĀ¶ČĻĀ£¬C(s) +CO2 (g) 2CO (g)Ę½ŗā³£ŹżK1£»
2CO (g)Ę½ŗā³£ŹżK1£»
C (s) +H2O(g) CO(g) +H2 (g)Ę½ŗā³£ŹżK2ŌņK”¢K1”¢K2,Ö®¼äµÄ¹ŲĻµŹĒ :
CO(g) +H2 (g)Ę½ŗā³£ŹżK2ŌņK”¢K1”¢K2,Ö®¼äµÄ¹ŲĻµŹĒ :
£Ø3£©8000CŹ±£¬ĻņŅ»øö10LµÄŗćČŻ·“Ó¦Ę÷ÖŠ³äČė0.40molCOŗĶ1.60molĖ®ÕōĘų£¬¾Ņ»¶ĪŹ±¼äŗó·“Ó¦“ļµ½Ę½ŗā£¬“ĖŹ±COµÄ×Ŗ»ÆĀŹĪŖ £ŗČō±£³ÖĘäĖūĢõ¼ž²»±ä£¬ĻņĘ½ŗāĢåĻµÖŠŌŁĶØČė0. 10molCOŗĶ0.40molCO2£¬“ĖŹ±vÕż vÄę (Ģī”°>”±”¢”°=”±»ņ”°<”±£©”£
(7·Ö)£Ø1£© C£ØCO2£©C£ØH2£©/C£ØCO£© C£ØH2O£©,(1·Ö) £¬< (1·Ö)£»
£Ø2£© K£½K2/K1 (1·Ö) £Ø3£©80% (2·Ö)£»£½(2·Ö)
½āĪöŹŌĢā·ÖĪö£ŗ£Ø1£©»ÆŃ§Ę½ŗā³£ŹżŹĒŌŚŅ»¶ØĢõ¼žĻĀ£¬µ±æÉÄę·“Ó¦“ļµ½Ę½ŗāדĢ¬Ź±£¬Éś³ÉĪļÅØ¶ČµÄĆŻÖ®»żŗĶ·“Ó¦ĪļÅØ¶ČµÄĆŻÖ®»żµÄ±ČÖµ£¬ĖłŅŌøł¾Ż·“Ó¦µÄ»Æѧ·½³ĢŹ½æÉÖŖ£¬øĆ·“Ó¦µÄĘ½ŗā³£Źż±ķ“ļŹ½K£½ ”£øł¾Ż±ķÖŠµÄŹż¾ŻæÉÖŖ£¬Ėę×ÅĪĀ¶ČµÄÉżøߣ¬Ę½ŗā³£ŹżKŹĒ¼õŠ”µÄ£¬ÕāĖµĆ÷ÉżøßĪĀ¶ČĘ½ŗāĻņÄę·“Ó¦·½Ļņ½ųŠŠ£¬ĖłŅŌÕż·½Ó¦ŹĒ·ÅČČ·“Ó¦£¬¼“”÷H£¼0”£
”£øł¾Ż±ķÖŠµÄŹż¾ŻæÉÖŖ£¬Ėę×ÅĪĀ¶ČµÄÉżøߣ¬Ę½ŗā³£ŹżKŹĒ¼õŠ”µÄ£¬ÕāĖµĆ÷ÉżøßĪĀ¶ČĘ½ŗāĻņÄę·“Ó¦·½Ļņ½ųŠŠ£¬ĖłŅŌÕż·½Ó¦ŹĒ·ÅČČ·“Ó¦£¬¼“”÷H£¼0”£
£Ø2£©øł¾ŻøĒĖ¹¶ØĀÉæÉÖŖ£¬¢Ś£¢Ł¼“µĆµ½·“Ó¦CO (g) +H2O (g) H2 (g) +CO2 (g)£¬ĖłŅŌĘ½ŗā³£ŹżÖ®¼äµÄ¹ŲĻµŹĒK£½K2/K1”£
H2 (g) +CO2 (g)£¬ĖłŅŌĘ½ŗā³£ŹżÖ®¼äµÄ¹ŲĻµŹĒK£½K2/K1”£
CO (g) +H2O (g) H2 (g) +CO2 (g)
H2 (g) +CO2 (g)
ĘšŹ¼ÅØ¶Č£Ømol/L£© 0.040 0.16 0 0
×Ŗ»ÆÅØ¶Č£Ømol/L£© x x x x
Ę½ŗāÅØ¶Č£Ømol/L£© 0.040£x 0.16£x x x
Ōņøł¾ŻøĆĪĀ¶ČĻĀµÄĘ½ŗā³£ŹżæÉÖŖ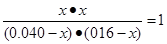
½āµĆx£½0.032mol/L
ĖłŅŌCOµÄ×Ŗ»ÆĀŹ£½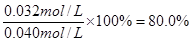
Čō±£³ÖĘäĖūĢõ¼ž²»±ä£¬ĻņĘ½ŗāĢåĻµÖŠŌŁĶØČė0. 10molCOŗĶ0.40molCO2£¬Ōņ“ĖŹ±CO”¢H2O”¢CO2”¢H2µÄÅØ¶Č·Ö±šŹĒ£Ømol/L£©0.018”¢0.128”¢0.072”¢0.032£¬ĖłŅŌQ£½ £¬ĖłŅŌ·“Ó¦ČŌČ»ŹĒĘ½ŗāדĢ¬£¬ŌņÕżÄę·“Ó¦ĖŁĀŹĻąµČ”£
£¬ĖłŅŌ·“Ó¦ČŌČ»ŹĒĘ½ŗāדĢ¬£¬ŌņÕżÄę·“Ó¦ĖŁĀŹĻąµČ”£
æ¼µć£ŗæ¼²éæÉÄę·“Ó¦Ę½ŗā³£ŹżµÄ¼ĘĖć”¢ÅŠ¶ĻŗĶÓ¦ÓĆ
µćĘĄ£ŗøĆĢāŹĒÖŠµČÄѶȵďŌĢā£¬Ņ²ŹĒøßæ¼ÖŠµÄ³£¼ūĢāŠĶ”£ŹŌĢāÕė¶ŌŠŌĒ棬Ö÷ŅŖŹĒæ¼²éѧɜ¶ŌĘ½ŗā³£Źżŗ¬Ņ唢±ķ“ļŹ½ŅŌ¼°ÓŠ¹ŲÓ¦ÓƵďģĻ¤ĮĖ½ā³Ģ¶Č£¬Ö¼ŌŚÅąŃųѧɜµÄĀß¼Ė¼Ī¬ÄÜĮ¦ŗĶ¹ę·¶“šĢāÄÜĮ¦”£ŌŚ½ųŠŠæÉÄę·“Ó¦µÄÓŠ¹Ų¼ĘĖ揱£¬Ņ»°ć²ÉÓĆ”°Čż¶ĪŹ½”±½ųŠŠ£¬¼“·Ö±šĮŠ³öĘšŹ¼Į攢×Ŗ»ÆĮæŗĶĘ½ŗāĮæ»ņijÉīæĢµÄĮæ£¬Č»ŗóŅĄ¾ŻŅŃÖŖĢõ¼žĮŠŹ½¼ĘĖć¼“æÉ”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
»ÆѧŌŚÄÜŌ“æŖ·¢ÓėĄūÓĆÖŠĘš×ÅŹ®·Ö¹Ų¼üµÄ×÷ÓĆ”£ĒāĘųŹĒŅ»ÖÖŠĀŠĶµÄĀĢÉ«ÄÜŌ“£¬ÓÖŹĒŅ»ÖÖÖŲŅŖµÄ»Æ¹¤ŌĮĻ”£
I£®ĒāŃõČ¼ĮĻµē³ŲÄÜĮæ×Ŗ»ÆĀŹøߣ¬¾ßÓŠ¹ćĄ«µÄ·¢Õ¹Ē°¾°”£ĻÖÓĆĒāŃõČ¼ĮĻµē³Ų½ųŠŠČēĶ¼ŹµŃé£ØĶ¼ÖŠĖłÓƵē¼«¾łĪŖ¶čŠŌµē¼«£©£ŗ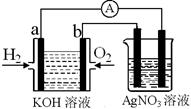
£Ø1£©¶ŌÓŚĒāŃõČ¼ĮĻµē³ŲÖŠ£¬ĻĀĮŠ±ķ“ļ²»ÕżČ·µÄŹĒ________
| A£®aµē¼«ŹĒøŗ¼«£¬OH£ŅĘĻņÕż¼« |
| B£®bµē¼«µÄµē¼«·“Ó¦ĪŖ£ŗO2£«2H2O£«4e££½4OH£ |
C£®µē³Ų×Ü·“Ó¦Ź½ĪŖ£ŗ2H2+O2 2H2O 2H2O |
| D£®µē½āÖŹČÜŅŗµÄpH±£³Ö²»±ä |
 2NH3(g) ¦¤H£½£92.20 kJ”¤mol£1”£
2NH3(g) ¦¤H£½£92.20 kJ”¤mol£1”£| Ź±¼ä£Øh£© ĪļÖŹµÄĮæ£Ømol£© | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | n2 | 1.00 | 1.00 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
Ė®ĆŗĘų×Ŗ»Æ·“Ó¦CO(g)+H2O(g)  CO2(g)+H2 (g)ŌŚŅ»¶ØĪĀ¶ČĻĀ“ļµ½»ÆŃ§Ę½ŗāדĢ¬”£
CO2(g)+H2 (g)ŌŚŅ»¶ØĪĀ¶ČĻĀ“ļµ½»ÆŃ§Ę½ŗāדĢ¬”£
Ķź³ÉĻĀĮŠĢīæÕ£ŗ
£Ø1£©Š“³öøĆ·“Ó¦µÄĘ½ŗā³£Źż±ķ“ļŹ½K=________________”£
£Ø2£©Ņ»¶ØĪĀ¶ČĻĀ£¬ŌŚŅ»øöČŻ»ż²»±äµÄĆܱÕČŻĘ÷ÖŠ·¢ÉśÉĻŹö·“Ó¦£¬ĻĀĮŠĖµ·ØÖŠÄÜÅŠ¶ĻøĆ·“Ó¦“ļµ½»ÆŃ§Ę½ŗāדĢ¬µÄŹĒ £ØŃ”Ģī±ąŗÅ£©”£
a£®ČŻĘ÷ÖŠµÄŃ¹Ēæ²»±ä b£®1 mol H£H¼ü¶ĻĮѵÄĶ¬Ź±¶ĻĮŃ2 molH£O¼ü
c£®vÕż(CO) = vÄę(H2O) d£®c(CO) = c(H2)
£Ø3£©½«²»Ķ¬ĮæµÄCO(g)ŗĶH2O(g)·Ö±šĶØČėµ½Ģå»żĪŖ2LµÄŗćČŻĆܱÕČŻĘ÷ÖŠ½ųŠŠ·“Ó¦£¬µĆµ½ČēĻĀŹµŃé×é1ŗĶŹµŃé×é2µÄŹż¾Ż£ŗ
| ŹµŃé×é | ĪĀ¶Č/”ę | ĘšŹ¼Įæ/mol | Ę½ŗāĮæ/mol | “ļµ½Ę½ŗāĖłŠčŹ±¼ä/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 3 |
| 2 | 650 | 1 | 2 | 0.8 | 1.2 | 5 |
| 3 | 950 | 1 | 2 | ”Ŗ | ”Ŗ | ”Ŗ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
ŌŚŅ»¶ØĢõ¼žĻĀ£¬NOÓėNO2»ģŗĻæÉÉś³ÉN2O3£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗNO(g)+NO2(g) N2O3(g) ¦¤H<0
N2O3(g) ¦¤H<0
ĻĀĶ¼±ķŹ¾Ņ»¶ØĮæµÄNO”¢NO2»ģŗĻĘųĢå·¢Éś·“Ó¦Ź±£¬NO2ÅضČŌŚĒ°25sÄŚµÄ±ä»Æ”£øĆ·“Ó¦½ųŠŠµ½45sŹ±“ļµ½Ę½ŗā£¬²āµĆNO2ÅضČŌ¼ĪŖ0.010mol/L”£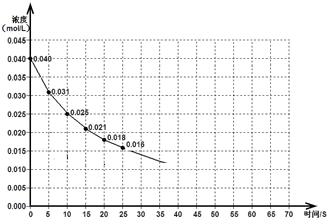
£Ø1£©Ē°20sÄŚ£¬NO2µÄĘ½¾ł·“Ó¦ĖŁĀŹĪŖ_________________”£
£Ø2£©ĘäĖūĢõ¼ž²»±ä£¬¢ŁÉżøßĪĀ¶Č£¬NO2µÄ×Ŗ»ÆĀŹ_______ £ØĢī”°Ōö“ó”±”¢”°¼õŠ””±»ņ”°²»±ä”±£©”£
¢ŚŃ¹ĖõĘųĢåĢå»ż£¬øĆ·“Ó¦Ę½ŗāĻņ_______ŅĘ¶Æ£ØĢī”°ÕżĻņ”±»ņ”°ÄęĻņ”±£©”£
£Ø3£©Čō·“Ó¦ŃÓŠųÖĮ70Ćė£¬ĒėŌŚ“šĢāæØĶ¼ÖŠ»³ö25ĆėÖĮ70ĆėµÄ·“Ó¦½ų³ĢĒśĻß”£
£Ø4£©ČōŌŚ·“Ó¦æŖŹ¼Ź±¼ÓČė“߻ƼĮ(ĘäĖūĢõ¼ž¶¼²»±ä)£¬ĒėŌŚ“šĢāæØĶ¼ÖŠ»³ö¼Ó“߻ƼĮŗóµÄ·“Ó¦½ų³ĢĒśĻß”£
£Ø5£©NO”¢NO2µÄ»ģŗĻĘųĢåÓĆNaOHČÜŅŗĪüŹÕ£¬µĆµ½µÄŃĪÖ»ÓŠŅ»ÖÖ£¬ŌņøĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗ___________________________________£¬øĆ·“Ó¦µÄŃõ»Æ¼ĮŹĒ______________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©·Ö±šÓĆÅØ”¢Ļ”ĻõĖįČܽāµČĮæµÄĮ½·ŻĶ·Ū£¬ĻūŗÄĻõĖįµÄĪļÖŹµÄĮæ½ĻÉŁµÄŹĒ____ ĻõĖį£ØĢī”°ÅØ”±»ņ”°Ļ””±£©£¬ĻąÓ¦µÄĄė×Ó·½³ĢŹ½ŹĒ ”£
£Ø2£© 800”ꏱ£¬ŌŚ2 LµÄŗćČŻĆܱÕČŻĘ÷ÖŠ³äČė2 mol NOŗĶ1mol O2·¢Éś·“Ó¦£¬2NO£Øg£©+O2£Øg£© 2NO2£Øg£©£¬¾5min“ļµ½Ę½ŗā£¬²āµĆc£ØNO£©=0£®5mol/L£¬²¢·ÅČČQ kJ”£
2NO2£Øg£©£¬¾5min“ļµ½Ę½ŗā£¬²āµĆc£ØNO£©=0£®5mol/L£¬²¢·ÅČČQ kJ”£
¢Ł5 minÄŚ v£ØO2£©= ”£
¢ŚøĆĢõ¼žĻĀ£¬2NO£Øg£©+O2£Øg£© 2NO2£Øg£©µÄ”÷H= ”£
2NO2£Øg£©µÄ”÷H= ”£
¢ŪČōĻņĘ½ŗā»ģŗĻĪļÖŠŌŁ³äČėNO”¢NO21mol£¬“ĖŹ±v v
v £ØĢī”°>”±”¢”°=”±»ņ”°<”±£©”£
£ØĢī”°>”±”¢”°=”±»ņ”°<”±£©”£
¢ÜČōĻņĘ½ŗā»ģŗĻĪļÖŠ½ö³äČė1mol NO2£¬Ę½ŗāĻņ____ £ØĢī”°ÕżĻņ”±”¢”°ÄęĻņ”±»ņ”°²»”±£©ŅĘ¶Æ”£“ļŠĀĘ½ŗāŹ±£¬NO2µÄĢå»ż·ÖŹż____ £ØĢī”°Ōö“ó”±”¢”°¼õŠ””±»ņ”°²»±ä”±£©”£
£Ø3£©Č¾ĮĻ¹¤ŅµÅŷŵķĻĖ®ÖŠŗ¬ÓŠ“óĮæÓŠ¶¾µÄNO £¬æÉŅŌŌŚĒæ¼īŠŌĢõ¼žĻĀ¼ÓČėĀĮ·Ū³żČ„£Ø·“Ó¦¹ż³ĢÖŠĪŽĘųĢ¬²śĪļÉś³É”£¼ÓČČ·“Ó¦ŗóµÄČÜŅŗÓŠÄÜŹ¹ŹŖČóµÄŗģÉ«ŹÆČļŹŌÖ½±äĄ¶µÄĘųĢåŅŻ³ö£©”£ĒėŠ“³öøĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½____ ”£
£¬æÉŅŌŌŚĒæ¼īŠŌĢõ¼žĻĀ¼ÓČėĀĮ·Ū³żČ„£Ø·“Ó¦¹ż³ĢÖŠĪŽĘųĢ¬²śĪļÉś³É”£¼ÓČČ·“Ó¦ŗóµÄČÜŅŗÓŠÄÜŹ¹ŹŖČóµÄŗģÉ«ŹÆČļŹŌÖ½±äĄ¶µÄĘųĢåŅŻ³ö£©”£ĒėŠ“³öøĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½____ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
Ņ»¶ØĪĀ¶ČŹ±£¬ŌŚČŻ»żŅ»¶ØµÄĆܱÕČŻĘ÷ÖŠ£¬·“Ó¦A(£æ)£«B(g)  C(g)£«D(g)“ļµ½Ę½ŗāŗó£¬ÉżøßĪĀ¶ČČŻĘ÷ÄŚĘųĢåµÄĆܶČŌö“ó”£Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
C(g)£«D(g)“ļµ½Ę½ŗāŗó£¬ÉżøßĪĀ¶ČČŻĘ÷ÄŚĘųĢåµÄĆܶČŌö“ó”£Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©Õż·“Ó¦ŹĒ £ØĢī”°·ÅČČ”±»ņ”°ĪüČČ”±£©·“Ó¦£»øĆ·“Ó¦µÄ»ÆŃ§Ę½ŗā³£ŹżµÄ±ķ“ļŹ½ŹĒ ”£
£Ø2£©ÄÜÅŠ¶ĻøĆ·“Ó¦Ņ»¶Ø“ļµ½Ę½ŗāדĢ¬µÄŅĄ¾ŻŹĒ ”££ØĢīŠ“×ÖÄø±ąŗÅ£©
A£®Ģå»ż·ÖŹż×é³ÉC£„£½D£„
B£®µ„Ī»Ź±¼äÄŚÉś³Én molAµÄĶ¬Ź±Éś³Én molC
C£®ĪĀ¶ČŗĶĢå»żŅ»¶ØŹ±£¬Ä³Ņ»Éś³ÉĪļÅØ¶Č²»ŌŁ±ä»Æ
D£®ĪĀ¶ČŗĶĢå»żŅ»¶ØŹ±£¬ČŻĘ÷ÄŚŃ¹Ēæ²»ŌŁ±ä»Æ
£Ø3£©øĆ·“Ó¦µÄÕż·“Ó¦ĖŁĀŹĖꏱ¼ä±ä»ÆµÄ¹ŲĻµČēĶ¼ĖłŹ¾”£t2Ź±øÄĮĖijÖÖĢõ¼ž£¬øıäµÄĢõ¼žŹĒ ”££ØĢīŠ“×ÖÄø±ąŗÅ£©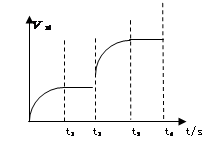
A£®ÉżĪĀ B£®¼ÓŃ¹ C£®“߻ƼĮ D£®Ōö¼ÓAµÄĮæ
£Ø4£©ÉżøßĪĀ¶Čµ½T”ꏱ£¬ŌŚŅ»ĆܱÕČŻĘ÷ÖŠ³äČė2mol AŗĶ3mol B£¬·¢ÉśÉĻŹö·“Ó¦”£Ę½ŗāŗó²āµĆK=1”£Č»ŗóŌŚĪĀ¶Č²»±äµÄĒéæöĻĀ£¬Ą©“óČŻĘ÷ČŻ»żÖĮŌĄ“µÄ10±¶£¬½į¹ūAµÄ°Ł·Öŗ¬ĮæŹ¼ÖÕĪ“øı䣬Ōņ“ĖŹ±BµÄ×Ŗ»ÆĀŹŹĒ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
½«Ņ»¶ØĮæµÄSO2ŗĶŗ¬0.7molŃõĘųµÄæÕĘų(ŗöĀŌCO2)·ÅČė0.5 LĆܱÕČŻĘ÷ÄŚ£¬550”ꏱ£¬ŌŚ“߻ƼĮ×÷ÓĆĻĀ·¢Éś·“Ó¦£ŗ2SO2(g)£«O2(g) 2SO3(g)(Õż·“Ó¦·ÅČČ)”£²āµĆn(O2)Ėꏱ¼äµÄ±ä»ÆČēĻĀ±ķ
2SO3(g)(Õż·“Ó¦·ÅČČ)”£²āµĆn(O2)Ėꏱ¼äµÄ±ä»ÆČēĻĀ±ķ
| Ź±¼ä/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(O2)/mol | 0.7 | 0.4 | 0.3 | x | x | x |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĪŹ“šĢā
(18·Ö)¼ī½šŹōŌŖĖŲµÄµ„ÖŹ¼°Ęä»ÆŗĻĪļ±»¹ć·ŗÓ¦ÓĆÓŚÉś²ś”¢Éś»īÖŠ”£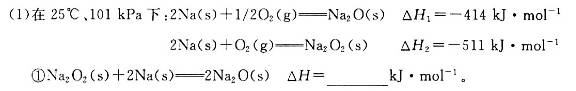
¢ŚŅ»¶ØĮæµÄNaŌŚ×ćĮæO2ÖŠ³ä·ÖČ¼ÉÕ£¬²Ī¼Ó·“Ó¦µÄO2Ģå»żĪŖ5.6 L(±ź×¼×“æö)£¬ŌņøĆ·“Ó¦¹ż³ĢÖŠ×ŖŅʵē×ӵďżÄæĪŖ_________”£
£Ø2£©½šŹōļ®¹ć·ŗÓ¦ÓĆÓŚ»ÆѧµēŌ“ÖĘŌģ£¬ļ®Ė®µē³Ų¾ĶŹĒĘäÖŠµÄŅ»ÖÖ²śĘ·”£øƵē³ŲŅŌ½šŹōļ®ŗĶ øÖ°åĪŖµē¼«²ÄĮĻ£¬ŅŌLiOHĪŖµē½āÖŹ£¬¼ÓČėĖ®¼“æɷŵē”£
×Ü·“Ó¦ĪŖ£ŗ2Li+2H2O=2LiOH+H2”ü
¢Łļ®Ė®µē³Ų·ÅµēŹ±£¬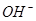 Ļņ_________¼«ŅĘ¶Æ”£
Ļņ_________¼«ŅĘ¶Æ”£
¢ŚŠ“³öøƵē³Ų·ÅµēŹ±Õż¼«µÄµē¼«·“Ó¦Ź½£ŗ_________________”£
¢Ūµē½āČŪČŚLiClæÉŅŌÖʱø½šŹōLi”£µ«LiC1ČŪµćŌŚ873 KŅŌÉĻ£¬øßĪĀĻĀµē½ā£¬½šŹōLi²śĮ漫µĶ”£¾¹żæĘѧ¼Ņ²»¶ĻŃŠ¾æ£¬·¢ĻÖµē½āLiCl”ŖKClµÄČŪŃĪ»ģŗĻĪļæÉŅŌŌŚ½ĻµĶĪĀ¶ČĻĀÉś³É½šŹōLi”£
ÄćČĻĪŖ£¬ČŪŃĪ»ģŗĻĪļÖŠKClµÄ×÷ÓĆŹĒ_________________________________________”£
Š“³öµē½āøĆČŪŃĪ»ģŗĻĪļ¹ż³ĢÖŠŃō¼«µÄµē¼«·“Ó¦Ź½£ŗ______________________________”£
£Ø3£©×īŠĀŃŠ¾æ±ķĆ÷£¬½šŹō¼ŲæÉ×÷¹¤ŅµÉĻĢģČ»ĘųøßĪĀÖŲÕūµÄ“߻ƼĮ£¬ÓŠ¹Ų·“Ó¦ĪŖ£ŗ ”£Ņ»¶ØĪĀ¶ČĻĀ£¬Ļņ2 LČŻ»ż²»±äµÄĆܱÕČŻĘ÷ÖŠ³äČė4 mol
”£Ņ»¶ØĪĀ¶ČĻĀ£¬Ļņ2 LČŻ»ż²»±äµÄĆܱÕČŻĘ÷ÖŠ³äČė4 mol 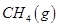 ŗĶ6 mo1 H2O(g)·¢Éś·“Ó¦£¬10 minŹ±£¬·“Ó¦“ļµ½Ę½ŗāדĢ¬£¬²āµĆCH4(g)ŗĶH2(g)µÄĪļÖŹµÄĮæĖꏱ¼ä±ä»ÆµÄĒśĻßČēĶ¼ĖłŹ¾”£
ŗĶ6 mo1 H2O(g)·¢Éś·“Ó¦£¬10 minŹ±£¬·“Ó¦“ļµ½Ę½ŗāדĢ¬£¬²āµĆCH4(g)ŗĶH2(g)µÄĪļÖŹµÄĮæĖꏱ¼ä±ä»ÆµÄĒśĻßČēĶ¼ĖłŹ¾”£
¢Ł0”«10 minÄŚÓĆ (CO)±ķŹ¾µÄ»Æѧ·“Ó¦ĖŁĀŹĪŖ_________”£
(CO)±ķŹ¾µÄ»Æѧ·“Ó¦ĖŁĀŹĪŖ_________”£
¢ŚĻĀĮŠŠšŹöÖŠ£¬Äܹ»Ö¤Ć÷øĆ·“Ó¦ŅŃ“ļµ½Ę½ŗāדĢ¬µÄŹĒ_________(ĢīŠņŗÅ)”£
a£®Éś³É3 molH-H¼üµÄĶ¬Ź±ÓŠ4 molC-H¼ü¶ĻĮŃ
b£®ĘäĖūĢõ¼ž²»±äŹ±£¬·“Ó¦ĢåĻµµÄŃ¹Ēæ±£³Ö²»±ä
c£®·“Ó¦»ģŗĻĘųĢåµÄÖŹĮæ±£³Ö²»±ä
d£®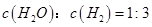
¢Ū“ĖĪĀ¶ČĻĀ£¬øĆ·“Ó¦µÄ»ÆŃ§Ę½ŗā³£ŹżK=_________mo12”¤L-2”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¼ĘĖćĢā
¼ÓČČŹ±£¬N2O5æÉ°“ĻĀĮŠ·Ö½ā£ŗN2O5 N2O3 + O2£¬N2O3ÓÖæÉ°“ĻĀĮŠ·Ö½ā£ŗ N2O3
N2O3 + O2£¬N2O3ÓÖæÉ°“ĻĀĮŠ·Ö½ā£ŗ N2O3 N2O + O2”£½ń½« 4 molN2O5³äČėŅ»ÉżĆܱÕČŻĘ÷ÖŠ£¬¼ÓČČÖĮ t”ꏱ·“Ó¦“ļµ½ĮĖĘ½ŗāדĢ¬”£Ę½ŗāŹ±£¬c£ØO2£©=" 4.5" mol/L, c£ØN2O3£©=" 1.62" mol/L,c£ØN2O£©= mol/L£¬“ĖŹ±N2O5µÄ·Ö½āĀŹĪŖ ”£
N2O + O2”£½ń½« 4 molN2O5³äČėŅ»ÉżĆܱÕČŻĘ÷ÖŠ£¬¼ÓČČÖĮ t”ꏱ·“Ó¦“ļµ½ĮĖĘ½ŗāדĢ¬”£Ę½ŗāŹ±£¬c£ØO2£©=" 4.5" mol/L, c£ØN2O3£©=" 1.62" mol/L,c£ØN2O£©= mol/L£¬“ĖŹ±N2O5µÄ·Ö½āĀŹĪŖ ”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com