
【题目】已知:H2(g)+I2(g)![]() 2HI(g);ΔH= -14.9kJ·mol-1。某温度下在甲、乙两个恒容密闭容器中充入反应物,其起始浓度如下表所示。甲中反应达到平衡时,测得c(H2)=0.008mol·L-1。下列判断正确的
2HI(g);ΔH= -14.9kJ·mol-1。某温度下在甲、乙两个恒容密闭容器中充入反应物,其起始浓度如下表所示。甲中反应达到平衡时,测得c(H2)=0.008mol·L-1。下列判断正确的
起始浓度 | c(H2)/(mol·L-1) | c(I2)/(mol·L-1) | c(HI)(mol·L-1) |
甲 | 0.01 | 0.01 | 0 |
乙 | 0.02 | 0.02 | 0 |
A.平衡时,乙中H2的转化率是甲中的2倍
B.平衡时,甲中混合物的颜色比乙中深
C.平衡时,甲、乙中热量的变化值相等
D.该温度下,反应的平衡常数K=0.25
【答案】D
【解析】
若甲的装置体积为1L,则乙装置可以看作刚开始体积为2L,待反应达到平衡时,再压缩容器至1L,由于该反应前后,气体的体积不变,所以压缩容器,压强增大,平衡不移动,则甲、乙两个体系除了各组分的物质的量、浓度是2倍的关系,其他的物理量,比如百分含量,转化率是一样的。
A. 假设甲装置体积为1L,乙装置体积刚开始为2L,平衡后再压缩至1L,由于反应前后气体体积不变,所以压缩容器后,平衡不移动,所以乙中H2的转化率和甲中的相同,A错误;
B. 平衡时,乙中I2的浓度是甲中的2倍,则乙中混合物颜色更深,B错误;
C. 平衡时,乙中HI的浓度是甲中的2倍,所以二者热量变化量不相等,C错误;
D. 甲中的三段式为(单位:mol·L-1):
H2(g)+ | I2(g) | 2HI(g) | |
1 | 1 | 2 | |
起 | 0.01 | 0.01 | 0 |
转 | 0.002 | 0.002 | 0.004 |
平 | 0.008 | 0.008 | 0.004 |
K=![]() =
=![]() =
=![]() =0.25,D正确;
=0.25,D正确;
故合理选项为D。


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
【题目】常温下,取pH=2的两种二元酸H2A与H2B各1mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是( )

A. H2A为二元弱酸,稀释前c(H2A)=0.005mol/L
B. NaHA水溶液中:c(Na+)+ c(H+)= 2c(A2-)+ c(OH-)
C. 含等物质的量的NaHA、NaHB的混合溶液中:c(Na+)= c(A2-)+ c(B2-)+ c(HB-)+ c(H2B)
D. pH=10的NaHB溶液中,离子浓度大小为:c(Na+)>c(HB-)>c(OH-)>c(B2-)>c(H2B)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有H+浓度均为0.1mol/L的醋酸甲和盐酸乙:
(1)请写出醋酸的电离常数的表达式:_____。
(2)取10 mL的甲溶液,加入等体积的水,醋酸的电离平衡__________(填“向左”、“向右”或“不”)移动,若加入少量的冰醋酸,醋酸的电离平衡________(填“向左”、“向右”或“不”)移动,若加入少量无水醋酸钠固体,待固体溶解后,溶液中c(H+)/c(CH3COOH)的值将________(填“增大”、“减小”或“无法确定”)。
(3)相同条件下,取等体积的甲、乙两溶液,加入足量的金属镁,开始反应时的速率:甲___乙(填“大于”、“小于”或“等于”)。产生氢气的体积:甲___乙(填“大于”、“小于”或“等于”)。
(4)0.1mol/L的甲溶液和0.05mol/L的甲溶液中氢离子浓度:前者是后者的_____。
A.小于2倍 B. 大于2倍 C. 等于2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校学习小组的同学拟用工业废铁屑(主要成分为Fe,还含有少量FeS、Fe3P等)制备FeSO4·7H2O,并探究FeSO4·7H2O高温分解的产物。
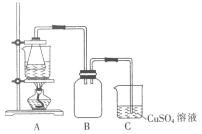
I.制备实验步骤如下:
①称取一定量的废铁屑,用热的碳酸钠溶液浸泡,再用蒸馏水洗涤。
②将处理后的废铁屑放入锥形瓶中,加入适量3mol·L-1的硫酸,连接好装置(如图)后水浴加热至反应完全。
③依据现象停止加热,趁热过滤,向滤液中补加少量硫酸。
④将滤液冷却、结晶、过滤、洗涤。
回答下列问题
(1)步骤②中需控制硫酸的用量,使铁粉过量,其目的是_____________________。
(2)装置C的作用是__________________________。
(3)步骤④中洗涤时所用的洗涤剂最好是______(填标号)。
A.稀硝酸 B.无水乙醇 C.苯
(4)测定产品的纯度:
称取mg产品,放入锥形瓶中,用经煮沸过且冷却的蒸馏水和稀硫酸溶解,然后用cmol·L-1的KMnO4标准溶液滴定,消耗VmLKMnO4标准溶液。
蒸馏水煮沸的原因:______________;产品的纯度为_________________(列出计算表达式即可)
Ⅱ.探究FeSO4·7H2O高温分解的产物的实验装置及步骤如下,请完成相关填空:
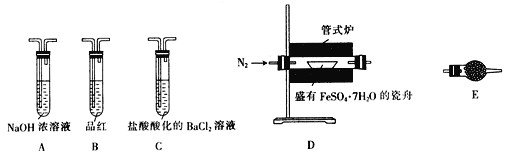
操作步骤 | 实验现象 | 解释原因 |
组装好仪器,先充入氮气,再加热管式炉至700℃一段时间 | 试管E中的白色固体变蓝 | 分解得到的产物中含水蒸气 |
气体产物经过试管B时 | 品红溶液褪色 | (5)产物中含有___________。 |
气体产物经过试管C时 | 试管C中出现白色沉淀 | (6)C中反应的化学方程式为________________________。 |
将瓷舟中反应后的固体溶于足量稀硫酸,再滴入几滴KSCN溶液 | (7)_________________。 | (8)溶液中中含有__________。 |
(9)依据实验现象及产物,写出FeSO4·7H2O分解的化学方程式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电镀废水沉泥中含Cu、Ni、Ag和Fe等多种元素的有机金属盐,采用焙烧一浸出—分离回收的工艺流程可有效分离电镀废水沉泥中的金属,其流程如下:
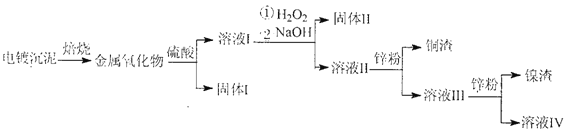
下列叙述错误的是
A. 上述流程中硫酸可以用稀盐酸代替
B. “固体Ⅱ”为Fe(OH)2
C. 溶液III中含有Na+、Ni2+、Zn2+等金属离子
D. 合理处理电镀废沉泥可实现资源的回收与可持续利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关酯化反应的说法正确的是( )
A.醇与酸的反应都是酯化反应
B.酯化反应和中和反应原理一样
C.酯化反应既属于取代反应,也属于可逆反应
D.酯化反应的机理是羧酸去掉氢原子而醇去掉羟基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于能量变化的说法正确的是( )
A.冰融化成水放出热量
B.生成物的总能量一定低于反应物的总能量
C.金属与酸反应生成氢气的过程吸收热量
D.化学键的断裂和形成是化学反应中能量变化的主要原因
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g) + O2(g)![]() 2SO3(g) ΔH = a kJ·mol-1,反应能量变化如图所示。下列说法中,不正确的是
2SO3(g) ΔH = a kJ·mol-1,反应能量变化如图所示。下列说法中,不正确的是

A.a<0
B.过程II可能使用了催化剂
C.使用催化剂可以提高SO2的平衡转化率
D.反应物断键吸收能量之和小于生成物成键释放能量之和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KIO3是一种重要的无机化合物,可作为食盐中的补碘剂。回答下列问题:
(1)KIO3的化学名称是_______。
(2)利用“KClO3氧化法”制备KIO3工艺流程如下图所示:

“酸化反应”所得产物有KH(IO3)2、Cl2和KCl。“逐Cl2”采用的方法是________。“滤液”中的溶质主要是_______。“调pH”中发生反应的化学方程式为__________。
(3)KIO3也可采用“电解法”制备,装置如图所示。
①写出电解时阴极的电极反应式______。
②电解过程中通过阳离子交换膜的离子主要为_________,其迁移方向是_____________。
③与“电解法”相比,“KClO3氧化法”的主要不足之处有______________(写出一点)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com