
| A. | 增大 | B. | 减小 | C. | 不变 | D. | 无法确定 |
科目:高中化学 来源:2016-2017学年湖北省高二上10月月考化学试卷(解析版) 题型:选择题
在日常生活中,我们经常看到铁制品生锈、钒制品表面出现白斑等众多的金属腐蚀现象。可以通过下列装置所示实验进行探究。下列说法正确的是 ( )

A.按图I装置实验,为了更快更清晰地观察到液柱上升,可采用下列方法:用酒精灯加热具支试管
B.图II是图I所示装置的原理示意图,图Ⅱ的正极材料是铁
C.铝制品表面出现白斑可以通过图Ⅲ装置进行探究,Cl-由活性炭区向铝箔表面区迁移,并发生电 极反应:2Cl--2e-=Cl2↑
极反应:2Cl--2e-=Cl2↑
D.图Ⅲ装置的总反应为4Al+3O2+6H2O=4Al(OH)3,生成的Al(OH)3进一步脱水形成白斑
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
将A和B加入密闭容器中,在一定条件下发生反应:A(g)+B(s) 2C(g),忽略固体体积,平衡时C的体积分数
2C(g),忽略固体体积,平衡时C的体积分数 (%)随温度和压强的变化如下表所示:
(%)随温度和压强的变化如下表所示:
压强/MPa 体积分数/% 温度/℃ | 1.0 | 2.0 | 3.0 |
800 | 54.0 | a | b |
900 | c | 75.0 | d |
1000 | e | f | 83.0 |
①a﹤b ②该反应的熵变△S﹤0 ③900℃、2.0MPa时A的转化率为60%
④K(1000℃)﹥K(800℃) ⑤正反应为吸热反应 上述①~⑤中正确的有( )
A.4个 B.3个 C.2个 D.1个
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/℃ | 5 | 15 | 25 | 35 | 50 |
| K | 1100 | 841 | 680 | 533 | 409 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在饱和氯水中通入H2S气体,溶液的pH变小 | |
| B. | 在饱和氯水中通入SO2气体,溶液的pH变小 | |
| C. | 在饱和氯水中加入CaCO3,平衡向右移,溶液的pH变大 | |
| D. | 在饱和氯水中加入NaOH使pH=7,所得溶液中微粒浓度:c(Na+)>c(ClO-)>c(Cl-)>c(HClO) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
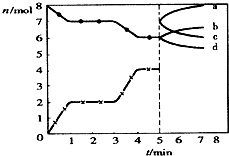
| A. | CO在2-3min和4-5min时平均速率相等 | |
| B. | 当固焦炭的质量不发生变化时,说明反应已达平衡状态 | |
| C. | 5min时再充入一定量的CO,n(CO)、n(CO2)的变化可分别由c、b曲线表示 | |
| D. | 3min时温度由T1升高到T2,重新平衡时K(T2)小于K(T1) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
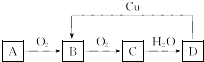
| A. | 氯 | B. | 铁 | C. | 碳 | D. | 氮 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 由反应可确定:氧化性HClO3>HClO4 | |
| B. | 变蓝的淀粉碘化钾试纸褪色是因为可能发生了:4C12+I2+6H2O→12H++8Cl-+2IO3- | |
| C. | 若氯酸分解所得的混合气体的平均摩尔质量为47.6g/mol,则反应方程式可表示为:26HClO3→15O2↑+8C12↑+10HClO4+8H2O | |
| D. | 若化学计量数a=8,b=3,则该反应转移电子数为20e |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com