
【题目】有物质的量浓度均为0.1molL-1的①NH4Cl溶液,②NaCl溶液,③HCl溶液各20mL,下列说法错误的是( )
A.三种溶液中c(Cl-)的关系是①=②=③
B.若将三种溶液稀释相同的倍数,pH变化最小的是②
C.三种溶液中由水电离出的c(H+)的关系是①<②<③
D.若向三种溶液中分别加入20mL0.1molL-1的NaOH溶液后,pH最小的是③
【答案】C
【解析】
A. ①NH4Cl在溶液中完全电离出氯离子和铵根离子,氯离子不水解,②NaCl在溶液中完全电离出氯离子和钠离子,氯离子不水解,③HCl在溶液中完全电离出氯离子和氢离子,氯离子不水解,物质的量浓度均为![]() 的上述溶液,
的上述溶液,![]() 都为
都为![]() ,即三种溶液中
,即三种溶液中![]() 的关系是
的关系是![]() ,故A正确;
,故A正确;
B. ![]() 为强酸弱碱盐,溶液水解呈酸性,加水稀释促进氯化铵水解,但溶液中氢离子浓度减小,溶液的pH增大,
为强酸弱碱盐,溶液水解呈酸性,加水稀释促进氯化铵水解,但溶液中氢离子浓度减小,溶液的pH增大,![]() 溶液为强酸强碱盐,溶液呈中性,加水稀释pH不变,
溶液为强酸强碱盐,溶液呈中性,加水稀释pH不变,![]() 为强酸,溶液呈酸性,加水稀释,PH变大,故B正确;
为强酸,溶液呈酸性,加水稀释,PH变大,故B正确;
C. ![]() 为强酸弱碱盐,溶液水解促进水的电离,
为强酸弱碱盐,溶液水解促进水的电离,![]() 溶液为强酸强碱盐,既不促进也不抑制水的电离,
溶液为强酸强碱盐,既不促进也不抑制水的电离,![]() 为强酸,抑制水的电离,所以水电离出的
为强酸,抑制水的电离,所以水电离出的![]() 的关系是
的关系是![]() ,故C错误;
,故C错误;
D. 若向三种溶液中分别加入![]() 的NaOH溶液后,
的NaOH溶液后,![]() 溶液,生成氯化钠和氨水,溶液呈碱性,
溶液,生成氯化钠和氨水,溶液呈碱性,![]() 溶液,不反应,溶液呈强碱性,
溶液,不反应,溶液呈强碱性,![]() 溶液反应生成氯化钠和水,溶液呈中性,所以pH最小的是
溶液反应生成氯化钠和水,溶液呈中性,所以pH最小的是![]() ,故D正确;
,故D正确;
综上所述,答案为C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】铁及其化合物在日常生产生活中用途广泛,利用FeSO4制备还原铁粉的工业流程如下:

实验室中可用FeSO4(用铁粉和稀硫酸反应制得)和NH4HCO3在如下装置模拟上述流程中的“转化”环节。

(1)装置A的名称是________,装置B中盛放的药品是________,NH4HCO3盛放在装置________中。
(2)实验过程中,欲将生成的FeSO4溶液和NH4HCO3溶液混合,操作方法是______________,
发生主要反应的离子方程式为_________。FeSO4溶液要现用现配制的原因是_______,检验久置的FeSO4是否变质的方法是_________________。
(3)干燥过程的主要目的是脱去游离水,该过程中会有少量FeCO3在空气中被氧化为FeOOH,该反应的化学方程式为________,取干燥后的FeCO3样品12.49 g,与炭混合后焙烧,最终得到还原铁粉6.16 g,计算样品中杂质FeOOH的质量:________ g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1表示:以相同的滴速分别向同体积的蒸馏水和0.1 mol/L CuSO4溶液中滴入NaCl溶液,氯离子浓度随氯化钠加入量的变化关系。图2表示:CuCl2溶液中氯离子浓度随温度变化关系。结合信息,下列推断不合理的是
已知:CuSO4溶液中存在平衡X:Cu2++4H2O![]() [Cu(H2O)4]2+(蓝色)
[Cu(H2O)4]2+(蓝色)
CuCl2溶液呈绿色,溶液中存在平衡Y:4Cl-+[Cu(H2O)4]2+![]() [CuCl4]2-+4H2O
[CuCl4]2-+4H2O
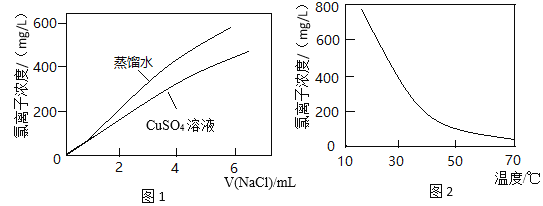
A.平衡Y是图1中两条曲线没有重合的主要原因
B.由图2可知平衡Y为吸热反应
C.平衡X是无水硫酸铜粉末和硫酸铜溶液颜色不同的原因
D.CuCl2溶液加水稀释,溶液最终变为浅绿色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组以4H++4I-+O2=2I2+2H2O为研究对象,探究影响氧化还原反应因素。
实验 | 气体a | 编号及现象 |
| HCl | Ⅰ.溶液迅速呈黄色 |
SO2 | Ⅱ.溶液较快呈亮黄色 | |
CO2 | Ⅲ.长时间后,溶液呈很浅的黄色 | |
空气 | Ⅳ.长时间后,溶液无明显变化 |
(1)实验Ⅳ的作用是______________。用CCl4萃取Ⅰ、Ⅱ、Ⅲ、Ⅳ的溶液,萃取后下层CCl4的颜色均无明显变化。
(2)取萃取后上层溶液,用淀粉检验:Ⅰ、Ⅲ的溶液变蓝;Ⅱ、Ⅳ的溶液未变蓝。溶液变蓝说明Ⅰ、Ⅲ中生成了______________。
(3)查阅资料:I2易溶于KI溶液。下列实验证实了该结论并解释Ⅰ、Ⅲ的萃取现象。

现象x是______________。
(4)针对Ⅱ中溶液未检出I2的原因,提出三种假设:
假设1:溶液中c(H+)较小。小组同学认为此假设不成立,依据是______________。
假设2:O2只氧化了SO2,化学方程式是______________。
假设3:I2不能在此溶液中存在。
(5)设计下列实验,验证了假设3,并继续探究影响氧化还原反应的因素。
i.取Ⅱ中亮黄色溶液,滴入品红,红色褪去。
ii.取Ⅱ中亮黄色溶液,加热,黄色褪去,经品红检验无SO2。加入酸化的AgNO3溶液,产生大量AgI沉淀,长时间静置,沉淀无明显变化。
iii.取Ⅱ中亮黄色溶液,控制一定电压和时间进行电解,结果如下。
电解时间/min | 溶液 | 阳极 | 阴极 |
t1 | 黄色变浅、有少量SO42- | 检出I2,振荡后消失 | H2 |
| 溶液无色、有大量SO42- | 检出I2,振荡后消失 | H2 |
结合化学反应,解释上表中的现象:______________。
(6)综合实验证据说明影响I-被氧化的因素及对应关系______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用标准![]() 溶液来测定未知浓度的盐酸的浓度:
溶液来测定未知浓度的盐酸的浓度:
(1)配制250mL 0.5mol/L的![]() 溶液所需的玻璃仪器为________________________。
溶液所需的玻璃仪器为________________________。
(2)用滴定管准确量取20.00mL未知浓度的盐酸于锥形瓶中,加入酚酞作指示剂,用![]() 溶液滴定到终点。
溶液滴定到终点。
该同学进行了三次实验,实验数据如下表:
实验编号 | 盐酸的体积(mL) | 标准 |
1 | 20.00 | 18.20 |
2 | 17.10 | |
3 | 16.90 |
滴定中误差较大的是第______次实验,造成这种误差的可能原因是______(填选项编号)
a、在盛装未知浓度的盐酸之前锥形瓶里面有少量蒸馏水,未烘干
b、滴定管在盛装标准![]() 溶液前未润洗
溶液前未润洗
c、滴定开始前盛装标准![]() 溶液的滴定管尖嘴部分有气泡,滴定终点读数时未发现气泡
溶液的滴定管尖嘴部分有气泡,滴定终点读数时未发现气泡
d、滴定开始前盛装标准![]() 溶液的滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
溶液的滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
e、滴定过程中,锥形瓶摇荡得太剧烈,以致有些液滴飞溅出来
f、达到滴定终点时,俯视溶液凹液面最低点读数
g、滴定到终点时,溶液颜色由无色变到了红色
(3)该同学所测得盐酸的物质的量浓度为______________________(结果保留三位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某研究性学习小组设计制取氯气并以氯气为反应物进行特定反应的装置

(1)①请写出装置A中发生反应的化学方程式______________________________________
②实验时,通常采用密度为1.19g/cm3、浓度为36.5%的浓盐酸。该浓盐酸的物质的量浓度_______。
③标准状况下,上述反应每生成4.48L氯气,转移电子的物质的量为________mol。
(2)要将C装置接入B和D之间,正确的接法是:a→________→________→d 。
(3)实验开始先点燃A处的酒精灯,打开活塞K,让Cl2充满整个装置,再点燃D处的酒精灯。Cl2通过C装置后进入D,D装置内盛有炭粉,发生氧化还原反应,生成CO2和HCl(g),发生反应的化学方程式为__________________________________________。为了使C装置发挥更好的作用,可向烧杯中加入浓硫酸,加入浓硫酸的作用是_______________________________。
(4) D处反应完毕后,关闭弹簧夹K,移去两个酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是______________________________,B的作用是________________________
(5)A、B、C、D、E装置中有一处需要改进,请画出改进后的装置图 ________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组在实验室中探究Ti、Mg、Cu的活泼性顺序。他们在相同温度下,取大小相同的三种金属薄片,分别投入等体积等浓度的足量稀盐酸中,现象如下:

下列有关三种金属的说法中正确的是( )
A.三种金属的活泼性由强到弱的顺序是Ti、Mg、Cu
B.若钛粉中混有Mg,提纯Ti时可用稀盐酸除去Mg
C.用Ti从CuSO4溶液中置换出Cu是工业制取Cu的很好途径
D.Cu和MgCl2溶液不发生化学反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G各物质间的关系如图,其中B、D为气态单质。

请回答下列问题。
(1)物质C和E的名称分别为_______、_______;
(2)可选用不同的A进行反应①,若能在常温下进行,其化学方程式为___________________;若只能在加热情况下进行,则反应物A应为_______;
(3)MnO2在反应①和反应②中的作用分别是_______、_______;
(4)新配制的F溶液应加入_______以防止其转化为G。检验G溶液中阳离子的常用试剂是_______,实验现象为_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NH3和CuO高温时反应能生成Cu和N2,某实验小组欲利用如图所示实验装置测定某5 g CuO(含Cu)样品的纯度
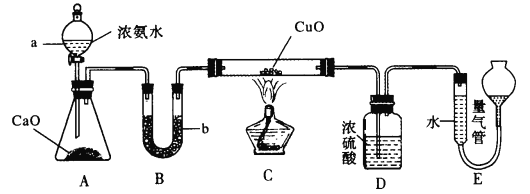
请回答下列问题:
(1)锥形瓶中的生石灰可用试剂____代替,仪器b中所盛试剂为______(填名称)。
(2)装置C中硬质玻璃管中发生反应的化学方程式为___________
(3)装置D的作用为________
(4)读取装置E中量气管中的气体体积时应注意的事项为_______
若装置E中所得气体体积在标准状况下时为336 mL,则样品中CuO的含量为___%。若读数时左边液面高于右边液面,则测得CuO含量将____(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com