
| A. | 25mL 0.1mol•L-1的BaCl2溶液 | B. | 50mL 0.3mol•L-1的NaCl溶液 | ||
| C. | 50 mL0.3mol•L-1的FeCl3溶液 | D. | 75 mL 0.1mol•L-1的KCl溶液 |
分析 25mL 0.1mol•L-1 AlCl3溶液中Cl-物质的量浓度是0.3mol/L,Cl-物质的量为0.3mol/L×0.025L=0.0075mol,以此解答.
解答 解:25mL 0.1mol•L-1 AlCl3溶液中Cl-物质的量浓度是0.3mol/L,Cl-物质的量为0.3mol/L×0.025L=0.0075mol,
A.25mL 0.1mol•L-1的BaCl2溶液中Cl-物质的量为0.025L×0.1mol/L×2=0.005mol,故A错误;
B.50mL 0.3mol•L-1的NaCl溶液中Cl-物质的量为0.05L×0.3mol/L=0.015mol,故B错误;
C.50 mL0.3mol•L-1的FeCl3溶液中Cl-物质的量为0.05L×0.3mol/L×3=0.045mol,故C错误;
D.75 mL 0.1mol•L-1的KCl溶液中Cl-物质的量为0.075L×0.1mol/L=0.075mol,故D正确.
故选D.
点评 本题考查物质的量浓度的计算,为高频考点,侧重于学生的计算能力的考查,题目难度不大,本题注意把握有关公式的运用.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量是4g | B. | 标准状况下的体积约为33.6L | ||
| C. | 电子数是3mol | D. | 分子数是9.03×1023 个 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下14克CO所含的原子数目为NA个 | |
| B. | 标准状况下0.8molCCl4含有的原子数目为4NA个 | |
| C. | 任何条件下0.5mol氮气分子的分子数一定是0.5NA | |
| D. | 49克硫酸中含有的原子数目为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
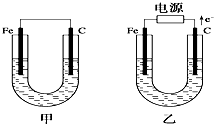 如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题:
如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(l)△H=-867 kJ•mol-1 | |
| B. | CH4催化还原NOx为N2的过程中,若x=1.6,则转移电子3.2 mol | |
| C. | 若0.2 mol CH4还原NO2至N2,在上述条件下放出的热量为173.4 kJ | |
| D. | 若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移电子3.2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含H+的溶液 | B. | H+浓度为1×10-6 mol/L的溶液 | ||
| C. | pH<7的溶液 | D. | c(OH-)<c(H+)的溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com