
(1)25℃时,0.01mol•L﹣1NaOH溶液的pH=
(2)25℃时,将1L pH=a的HCl与100L pH=11的NaOH溶液混合后,溶液呈中性,则a= .
考点:
pH的简单计算.
专题:
电离平衡与溶液的pH专题.
分析:
(1)由氢氧根离子的浓度,根据水的离子积常数求出氢离子的浓度,然后求出PH;
(2)酸、碱都是强电解质,溶液呈中性说明氢离子和氢氧根离子的物质的量相等,结合水的离子积常数确定.
解答:
解:(1)NaOH为强电解质,则0.01mol/L的NaOH溶液中c(OH﹣)=0.01mol/L,c(H+)= mol/L=1×10﹣12mol/L,该氢氧化钠溶液的pH=﹣lg1×10﹣12=12,故答案为:12;
mol/L=1×10﹣12mol/L,该氢氧化钠溶液的pH=﹣lg1×10﹣12=12,故答案为:12;
(2)液呈中性说明氢离子和氢氧根离子的物质的量相等,即1×10﹣a=1011﹣14×100L,所以a=1,故答案为:1.
点评:
本题考查了溶液pH的计算,题目难度中等,注意掌握溶液酸碱性与溶液pH的计算方法,明确酸与酸、碱与碱、酸与碱的混合液的pH的计算方法,试题培养了学生的分析、理解能力及化学计算能力.


科目:高中化学 来源: 题型:
2008年秋天,毒奶粉事件震惊全国,这主要是奶粉中含有有毒的三聚氰胺.下列关于三聚氰胺分子的说法正确的是( )
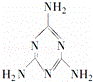
|
| A. | 所有碳原子采用sp3杂化,所有氮原子采用sp3杂化 |
|
| B. | 一个分子中共含有15个σ键 |
|
| C. | 属于极性分子,故极易溶于水 |
|
| D. | 分子内既有极性键又有非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在CH3COOH⇌H++CH3COO﹣的电离平衡中,要使电离平衡右移且氢离子浓度增大,应采取措施是( )
|
| A. | 加入NaOH | B. | 加入盐酸 | C. | 加水 | D. | 升高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,CO和CH4燃烧的热化学方程式分别为
2CO(g)+O2(g)═2CO2(g)△H=﹣566kJ•mol﹣1
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣890kJ•mol﹣1
由1mol CO(g)和3mol CH4(g)组成的混合气体在上述条件下充分燃烧,恢复至室温释放的热量为( )
|
| A. | 2912kJ | B. | 2953kJ | C. | 3236kJ | D. | 3867kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
H2A为弱电解质,0.1mol/LH2A水溶液加水稀释为0.01mol/L时,下列各粒子的浓度减小最多的是( )
|
| A. | A2﹣ | B. | HA﹣ | C. | H+ | D. | H2A |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组热化学方程式中,化学反应的△H前者大于后者的是( )
①C(s)+O2(g)═CO2(g);△H1 C(s)+ O2(g)═CO(g);△H2
O2(g)═CO(g);△H2
②S(s)+O2(g)═SO2(g);△H3 S(g)+O2(g)═SO2(g);△H4
③H2(g)+ O2(g)═H2O(l);△H5 2H2(g)+O2(g)═2H2O(l);△H6
O2(g)═H2O(l);△H5 2H2(g)+O2(g)═2H2O(l);△H6
④CaCO3(s)═CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)═Ca(OH)2(s);△H8.
|
| A. | ① | B. | ④ | C. | ②③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子在指定的溶液中能大量共存的是( )
①无色溶液中:K+、Cu2+、Na+、SO42﹣
②常温下pH=11的溶液中:CO32﹣、Na+、AlO2﹣、NO3﹣
③加入Al能放出H2的溶液中:Cl﹣、HCO3﹣、NO3﹣、NH4+
④在由水电离出的c(OH﹣)=10﹣13 mol•L﹣1的溶液中:Na+、Ba2+、Cl﹣、I﹣
⑤能使红色石蕊试纸变为蓝色的溶液:Na+、Al3+、Cl﹣、S2﹣
⑥使pH试纸呈红色的溶液中:Fe2+、Al3+、NO3﹣、Cl﹣.
|
| A. | ②④ | B. | ③⑤ | C. | ④⑥ | D. | ②⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com