
可燃冰中蕴藏着大量的甲烷,有望成为未来新能源。已知1 mol CH4气体完全燃烧生成CO2气体和液态H2O时放出的热量为890.3 kJ,当它不完全燃烧生成CO气体和液态H2O时,放出的热量为519 kJ。如果1 mol CH4在n g O2中燃烧生成CO、CO2气体和液态H2O,放出731.25 kJ热量。
(1)写出表示甲烷燃烧热的热化学方程式。
(2)写出甲烷气体不完全燃烧的热化学方程式。
(3)计算n的值。
(1)1 mol CH4完全燃烧生成CO2气体和液态水放出的热量就是CH4的燃烧热,所以表示甲烷燃烧热的热化学方程式为CH4(g)+2O2(g)====CO2(g)+
2H2O(l) ΔH=-890.3 kJ·mol-1。
(2)CH4气体不完全燃烧的热化学方程式写成下面两种形式都可以:
CH4(g)+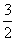 O2(g)====CO(g)+2H2O(l) ΔH=-519 kJ·mol-1 ①
O2(g)====CO(g)+2H2O(l) ΔH=-519 kJ·mol-1 ①
或2CH4(g)+3O2(g)====2CO(g )+4H2O(l) ΔH=-1 038 kJ·mol-1
)+4H2O(l) ΔH=-1 038 kJ·mol-1
(3)CH4气体完全燃烧的热化学方程式为:
CH4(g)+2O2(g)====CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1 ②
设1 mol CH4中,发生反应①②的CH4的物质的量分别为x、y,则有:

解得:x≈0.43 mol,y≈0.57 mol
相应消耗O2的质量为:(3x/2+2y)mol×32 g·mol-1=57.12 g。
答案:(1)CH4(g)+2O2(g)====CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
(2)CH4(g)+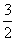 O2(g)====C
O2(g)====C O(g)+2H2O(l) ΔH=-519 kJ·mol-1
O(g)+2H2O(l) ΔH=-519 kJ·mol-1
或2CH4(g)+3O2(g)====2CO(g)+4H2O(l) ΔH=-1 038 kJ·mol-1
(3)n=57.12


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
三苯甲醇是一种重要有机合成中间体,可以通过下列原理进行合成:
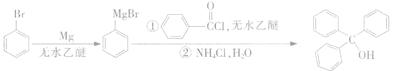
实验步骤如下:
①如图1所示,在三颈烧瓶中加入1.5 g镁屑,在滴液漏斗中加入6.7 mL溴苯和无水乙醚,先加人1/3混合液于烧瓶中,待镁屑表面有气泡产生时,开始搅拌,并逐滴加入余下的混合液,使反应液保持微沸状态,至反应完全。
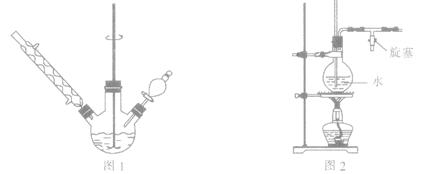
②继续加入3.7 g苯甲酰氯和无水乙醚,水浴回流l h 后,在冷水浴下慢慢滴加氯化铵的饱和溶液30.0 mL。
③将三颈烧瓶内的物质水浴加热蒸去乙醚,然后加入30.0 mL水进行水蒸气蒸馏(图2用作水蒸气发生装置),直至无油状物蒸出。
④冷却抽滤,将固体用80.0%的乙醇溶液重结晶,最终得到产品。
(1)步骤①中“逐滴加入余下的混合液”是为了防止 。
(2)若水蒸气蒸馏装置中出现堵塞现象,则图2玻璃管中水位会突然升高,此时应 ,待故障排除后再进行蒸馏。
(3)抽滤用到的主要仪器有气泵、 ,抽滤优于普通过滤的显著特点是 。
(4)步骤④中用80.0%的乙醇溶液重结晶的目的是 。
(5)用光谱法可检验所得产物是否纯净,其中用来获得分子中含有何种化学键和官能团信息的方法 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述是小明做完铜、锌原电池的实验后得出的结论和认识,你认为正确的是( )
A.构成原电池正极和负极的材料必须是两种金属
B.由铜、锌作电极与硫酸铜溶液组成的原电池中铜是负极
C.电子沿外导线由锌流向铜,通过硫酸溶液被氢离子得到而放出氢气
D.铜锌原电池工作时,若有13克锌被溶解,电路中就有0.4 mol电子通过
查看答案和解析>>
科目:高中化学 来源: 题型:
有关热化学方 程式书写与对应表述均正确的是( )
程式书写与对应表述均正确的是( )
A.稀醋酸与0.1 mol·L-1 NaOH溶液反应:
H+(aq)+OH-(aq)====H2O(l) ΔH=-57.3 kJ·mol-1
B.氢气的燃烧热为285.5 kJ·mol-1, 则水分解的热化学方程式
2H2O(l)====2H2(g)+O2(g) ΔH=+285.5 kJ·mol-1
C.密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量。 则Fe(s)+S(s)====FeS(s) ΔH=-95.6 kJ·mol-1
D.已知2C(s)+O2(g)====2CO(g) ΔH=-221 kJ·mol-1,则可知C的燃烧热为110.5 kJ·m ol-1
ol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
将下图所示实验装置的K闭合,下列判断正确的是( )
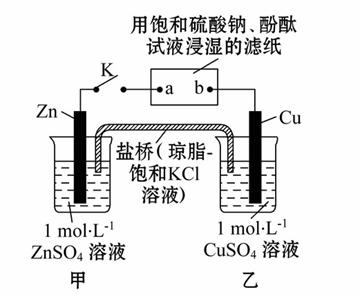
A.Cu电极上发生还原反应
B.电子沿Zn→a→b→Cu路径流动
C.片刻后甲池中c(SO42-)增大
D.片刻后可观察到滤纸b点变红色
查看答案和解析>>
科目:高中化学 来源: 题型:
将2 mol X和2 mol Y充入2 L的密闭容器中发生如下反应:X(g)+3Y(g)  2Z(g)+aQ(g),2 min达到平衡时生成0.8 mol Z,测得Q的浓度为
2Z(g)+aQ(g),2 min达到平衡时生成0.8 mol Z,测得Q的浓度为
0.4 mol·L-1,下列叙述错误的是( )
A.a的值为2
B.平衡时X的浓度为0.2  mol·L-1
mol·L-1
C.Y的转化率为60%
D.反应速率v(Y)=0.3 mol·(L·min)-1
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下测得在2 L的容器中,M、N、P三种气体物质的量的变化如图所示,则有关该反应的说法正确的是( )
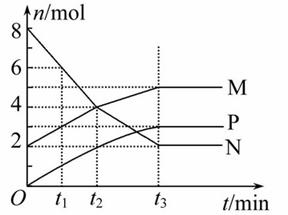
A.该温度下的平衡常数为3.75
B.若升高温度,测得M的转化率增大,则该反应的正反应为吸热反应
C.t3时,正反应速率大于逆反应速率
D.若测得 该反应在一段时间内压强不变,说明反应达到平衡
该反应在一段时间内压强不变,说明反应达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
在0.1 mol·L-1 NaHCO3溶液中有关微粒浓度的关系正确的是( )
A.[Na+]+[H+]=[HCO3-]+[CO32-]+[OH-]
B.[Na+]=[HCO3-]+[CO32-]+[H2CO3]
C.[Na+]>[HCO3-]>[CO32-]>[H+]>[OH-]
D.[OH-]=[H+]+[H2CO3]+[HCO3-]
查看答案和解析>>
科目:高中化学 来源: 题型:
CO和NO都是汽车尾气中的有害物质,它们之间能缓慢地发生如下反应:2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH<0,现利用此反应,拟设计一种环保装置,用来消除汽车尾气对大气的污染,下列设计方案可以提高尾气处理效果且可行的是( )
①选用适当的催化剂 ②提高装置温度 ③降低装置的压强 ④装置中放入碱石灰
A.①③ B.②④
C.①④ D.②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com