
【题目】硫化氢分解制取氢气和硫磺的反应原理为2H2S(g)![]() S2(g)+2H2(g),在2.0 L恒温恒容密闭容器中充入2.0 mol H2S,反应过程中的部分数据如下表所示:
S2(g)+2H2(g),在2.0 L恒温恒容密闭容器中充入2.0 mol H2S,反应过程中的部分数据如下表所示:
n/mol t/min | n(H2S) | n(S2) | n(H2) |
0 | 2.0 | 0 | 0 |
2 | 1.0 | ||
4 | 0.8 | ||
6 | 0.6 |
下列说法不正确的是( )
A.0~2min 生成H2的平均反应速率为0.25 mol·L-1·min-1
B.上述反应的平衡常数K=0.675
C.3分钟时,H2S的分解率一定小于60%
D.平衡后,向容器中通入少量O2,平衡正向移动
【答案】C
【解析】
第2min时,n(H2)=1.0mol,说明生成了1.0mol H2,则生成0.5molS2,消耗1.0molH2S;
第4min时,H2S还剩0.8mol,说明消耗了(2-0.8)molH2S,即消耗了1.2molH2S,则生成0.6molS2,生成1.2molH2;
第6min时,n(S2)=0.6mol,说明生成了0.6molS2,则生成1.2molH2,消耗1.2molH2S;
综上所述:
n/mol t/min | n(H2S) | n(S2) | n(H2) |
0 | 2.0 | 0 | 0 |
2 | 1.0 | 0.5 | 1.0 |
4 | 0.8 | 0.6 | 1.2 |
6 | 0.8 | 0.6 | 1.2 |
据此分析解答。
A.0~2min 生成1.0molH2,则v(H2)=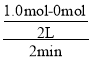 = 0.25 mol·L-1·min-1,A正确;
= 0.25 mol·L-1·min-1,A正确;
B.结合上面的分析可知,第4min到第6min,体系中各组分的物质的量不变,则4min时,反应已平衡,且平衡时H2S、S2、H2的物质的量分别为:0.8mol、0.6mol、1.2mol,因为容器体积为2.0L,则H2S、S2、H2的平衡浓度分别为:0.4mol/L、0.3mol/L、0.6mol/L,所以,平衡常数Kc=![]() =0.675,B正确;
=0.675,B正确;
C.平衡时,H2S的分解率=![]() =60%,由分析可知,无法确定3min时是否已达平衡,若3min时反应已平衡,则H2S的分解率为60%,若3min时反应未平衡,则H2S的分解率小于60%,C错误;
=60%,由分析可知,无法确定3min时是否已达平衡,若3min时反应已平衡,则H2S的分解率为60%,若3min时反应未平衡,则H2S的分解率小于60%,C错误;
D.S2为蒸汽,说明反应温度较高,向容器中通入少量O2,消耗硫磺和氢气,导致生成物浓度减小,平衡正向移动,D正确。
答案选C。


 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:
【题目】一种新型燃料电池,用两根金属Pt作电极插入KOH溶液中,然后向两极分别通入甲烷和氧气,其电极反应式为X极:CH4+10OH--8e-=CO32—+7H2O; Y极:4H2O+2O2+8e-=8OH-。下列关于此燃料电池的说法中,错误的是
A.X为负极,Y为正极
B.该电池工作时,X极附近溶液的碱性增强
C.在标准状况下,通入 5.6 L O2完全反应后,有1 mol电子发生转移
D.工作一段时间后,KOH的物质的量减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置及试剂进行铁的电化学腐蚀实验探究,测定具支锥形瓶中压强随时间变化关系以及溶解氧随时间变化关系的曲线如下。

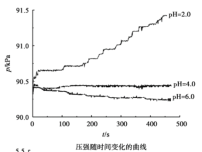
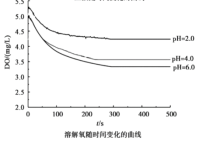
下列说法不正确的是
A.压强增大主要是因为产生了H2
B.整个过程中,负极电极反应式为:Fe–2e- = Fe2+
C.pH= 4.0时,不发生析氢腐蚀,只发生吸氧腐蚀
D.pH= 2.0时,正极电极反应式为:2H+ + 2e- = H2↑ 和 O2 + 4e- + 4H+ = 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.乙醛和乙烯均能使溴水褪色,两者的反应原理不同
B.淀粉和纤维素均可以制酒精,酒精在某种微生物作用下发生氧化反应得到醋酸
C.蛋白质溶液在强酸、强碱、紫外线和加热条件下都能发生变性
D.甲苯的一氯代物有4种,甲苯与氢气加成后的产物的一氯代物也只有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,三个容积相同的烧瓶内分别充满了干燥的NH3、HCl、NO2气体,然后分别用水作喷泉实验,假设烧瓶内的溶质不散逸,则三种溶液的物质的量浓度之比为 ( )
A. 无法比较B. 2∶2∶3C. 3∶3∶ 2D. 1∶1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图两瓶体积相等的气体,在同温同压时瓶内气体的关系一定正确的是( )

A. 所含原子数相等 B. 气体密度相等C.气体质量相等 D.摩尔质量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池是目前电池研究的热点之一。某课外小组自制的氢氧燃料电池如图所示,a、b均为惰性电极,下列叙述错误的是( )
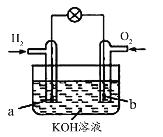
A.a极是负极,该电极上发生氧化反应
B.b极发生的电极反应是O2+4OH――4e-=2H2O
C.电池总反应方程式为2H2+O2=2H2O
D.溶液中OH-向正极移动,K+、H+向负极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用乙酸和乙醇在浓硫酸作用下制取乙酸乙酯的装置如图。下列说法正确的是
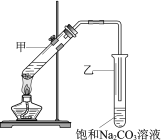
A. 向甲试管中先加浓硫酸,再加乙醇和乙酸
B. 乙试管中导管不伸入液面下,是为了防止倒吸
C. 加入过量乙酸,可使乙醇完全转化为乙酸乙酯
D. 实验完毕,可将乙酸乙酯从混合物中过滤出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常监测SO2含量是否达到排放标准的反应原理是SO2+H2O2+BaCl2=BaSO4↓+2HCl。设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.0.1molBaCl2晶体中所含离子总数为0.2NA
B.25℃时,pH=1的HC1溶液中含有H+的数目为0.1NA
C.17gH2O2中含有非极性键数目为0.5NA
D.生成2.33gBaSO4沉淀时,转移电子数目为0.01NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com