
ЎѕМвДїЎїIЎўФЪТ»ёц2LµДГЬ±ХИЭЖчЦРЈ¬·ўЙъ·ґУ¦2SO3ЈЁgЈ©![]() 2SO2ЈЁgЈ©+O2ЈЁgЈ©Ј»ЎчHЈѕ0Ј¬ЖдЦРSO3µД±д»ЇИзНјЛщКѕЈє
2SO2ЈЁgЈ©+O2ЈЁgЈ©Ј»ЎчHЈѕ0Ј¬ЖдЦРSO3µД±д»ЇИзНјЛщКѕЈє
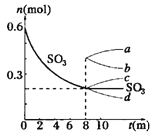
ЈЁ1Ј©УГO2±нКѕ0Ў«8minДЪёГ·ґУ¦µДЖЅѕщЛЩВКv=__________Ј®
ЈЁ2Ј©ЙэёЯОВ¶ИЈ¬ KЦµЅ«__________Ј»ИЭЖчЦРЖшМеµДЖЅѕщПа¶Ф·ЦЧУЦКБїЅ«__________Ј®ЈЁМоЎ°ФцґуЎ±Ў°јхРЎЎ±»тЎ°І»±дЎ±Ј©
ЈЁ3Ј©ДЬЛµГчёГ·ґУ¦ТСґпµЅЖЅєвЧґМ¬µДКЗ__________
aЈ®vЈЁSO3Ј©=2vЈЁO2Ј© bЈ®ИЭЖчДЪС№Зї±ЈіЦІ»±д
cЈ®vДжЈЁSO2Ј©=2vХэЈЁO2Ј© dЈ®ИЭЖчДЪГЬ¶И±ЈіЦІ»±д
ЈЁ4Ј©ґУ8minЖрЈ¬С№ЛхИЭЖчОЄ1LЈ¬ФтSO3µД±д»ЇЗъПЯОЄ__________
AЈ® a BЈ® b CЈ® c DЈ® dЈ®
IIЎўЅ«ЖшМеAЎўBЦГУЪИЭ»эОЄ2LµДГЬ±ХИЭЖчЈ¬·ўЙъИзПВ·ґУ¦Јє4AЈЁgЈ©+BЈЁgЈ©=2CЈЁgЈ©ЖрКјК±ідИл0.5molBєНТ»¶ЁБїµДAЈ¬·ґУ¦ЅшРРµЅ4sД©Ј¬ІвµГvЈЁBЈ©=0.0125molЎ¤L-1Ў¤s-1Ј¬AЎўCѕщОЄ0.2molЎЈФт
ЈЁ1Ј©VЈЁAЈ© =____________
ЈЁ2Ј©·ґУ¦З°AУР_________mol
ЈЁ3Ј©BµДЧЄ»ЇВКОЄ____________
Ўѕґр°ёЎї¦©Ј®ЈЁ1Ј©0.0125 mol/ЈЁLminЈ©ЈЁ2·ЦЈ©
ЈЁ2Ј©Фцґу ЈЁ2·ЦЈ© јхРЎ ЈЁ2·ЦЈ©
ЈЁ3Ј©b c ЈЁ2·ЦЈ©
ЈЁ4Ј©cЈЁ2·ЦЈ©
ўтЈ®ЈЁ1Ј©0.05 molL-1s-1 ЈЁ2·ЦЈ© ЈЁ2Ј©0.6 mol ЈЁ2·ЦЈ© ЈЁ3Ј©20% ЈЁ2·ЦЈ©
ЎѕЅвОцЎї
КФМв·ЦОцЈє¦©Ј®ЈЁ1Ј©УГO2±нКѕ0Ў«8minДЪёГ·ґУ¦µДЖЅѕщЛЩВКv=ЈЁ0.6-0.3Ј©/2/8=0.0125 mol/ЈЁLminЈ©Ј» ЈЁ2Ј©ЎчHЈѕ0,ёГ·ґУ¦ОьИИЈ¬ЙэёЯОВ¶ИЈ¬ KЦµЅ«ФцґуЈ»ЖЅєвУТТЖЈ¬»мєПЖшМеµДЧЬЦКБїІ»±дЈ¬ЧЬБї±дґуЈ¬ТтґЛИЭЖчЦРЖшМеµДЖЅѕщПа¶Ф·ЦЧУЦКБїЅ«јхЙЩЈ»ЈЁ3Ј©aЈ®vЈЁSO3Ј©=2vЈЁO2Ј©Г»УР±кХэДжЈ¬ґнОуЈ»bЈ®ёГ·ґУ¦ОЄТ»ёцЖшМеМе»э±дґуµД·ґУ¦Ј¬ИЭЖчДЪС№Зї±ЈіЦІ»±д Ј¬·ґУ¦ґпЖЅєвЧґМ¬Ј»ХэИ·cЈ®vДжЈЁSO2Ј©=2vХэЈЁO2Ј© ±кіцХэДжЈ¬ЗТЛЩВК±ИєНПµКэіЙХэ±ИЈ»ґнОуЈ»dЈ®ИЭЖчµДМе»эІ»±дЈ¬·ґУ¦З°єуЖшМеµДЧЬЦКБїІ»±дЈ¬ГЬ¶ИКјЦХОЄ¶ЁЦµЈ¬ИЭЖчДЪГЬ¶И±ЈіЦІ»±дІ»ДЬЧчОЄЕР¶ПЖЅєвµДТАѕЭЈ¬ґнОуЈ»ХэИ·ґр°ёОЄb єНcЈ»ЈЁ4Ј©ґУ8minЖрЈ¬С№ЛхИЭЖчОЄ1LЈ¬ЖЅєвЧуТЖЈ¬SO3 µДБїФцґуЈ¬ c ·ыєПМвТвЈ»
ўтЈ®ёщѕЭAєНCµД№ШПµКЅЦЄЈ¬ЙъіЙ0.2molµДCРиТЄAµДОпЦКµДБї= [0.2/2]ЎБ4=0.4molЈ» vA= 0.4/2/4=0.05mol/ЈЁLЈ®sЈ© Ј»vЈЁBЈ©=0.0125molЎ¤L-1Ў¤s-1Ј¬ПыєДnЈЁBЈ©=0.0125ЎБ2ЎБ4=0.1 molЈ»
4AЈЁgЈ©+BЈЁgЈ©=2CЈЁgЈ©
ЖрКј 0.5 0
±д»Ї 0.4 0.1 0.2
4sД©Ј¬0.2 0.2
ёщѕЭЙПКц№ШПµїЙТФїґіцЈє·ґУ¦З°AУР0.4+0.2=m0.6olЈ»BµДЧЄ»ЇВК= 0.1/0.5ЎБ100%=20%


 53ЛжМГІвПµБРґр°ё
53ЛжМГІвПµБРґр°ё
| Дкј¶ | ёЯЦРїОіМ | Дкј¶ | іхЦРїОіМ |
| ёЯТ» | ёЯТ»Гв·СїОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СїОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СїОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СїОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СїОіМНЖјцЈЎ | іхИэ | іхИэГв·СїОіМНЖјцЈЎ |
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїФЪТ»¶ЁОВ¶ИПВЈ¬Ѕ«XєНY ёч0.16 molідИл10 L єгИЭГЬ±ХИЭЖчЦРЈ¬·ўЙъ·ґУ¦Јє2X(g)+ Y(s)![]() 2Z(g) ЎчH < 0Ј¬Т»¶ОК±јдєуґпµЅЖЅєвЎЈ·ґУ¦№эіМЦРІв¶ЁµДКэѕЭИзПВ±нПВБРЛµ·ЁХэИ·µДКЗ( )
2Z(g) ЎчH < 0Ј¬Т»¶ОК±јдєуґпµЅЖЅєвЎЈ·ґУ¦№эіМЦРІв¶ЁµДКэѕЭИзПВ±нПВБРЛµ·ЁХэИ·µДКЗ( )
t / min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.10 | 0.09 | 0.09 |
AЈ®·ґУ¦З°2minµДЖЅѕщЛЩВКv(Z)=2.0ЎБ10-3 mol/(LЎ¤min)
BЈ®ЖдЛыМхјюІ»±дЈ¬јУИлТ»¶ЁБїµДYЈ¬·ґУ¦ЛЩВКТ»¶ЁјУїм
CЈ®·ґУ¦ЅшРР4sК±Ј¬XµДЧЄ»ЇВК75%
DЈ®·ґУ¦ґпµЅЖЅєвК±Ј¬XµДОпЦКµДБїЕЁ¶ИОЄ0.02molЎ¤L-1
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїПВБРЛµ·ЁХэИ·µДКЗ
A. мК±дєНмШ±д¶јґуУЪ0µД·ґУ¦їП¶ЁКЗЧФ·ўµД
B. мК±дРЎУЪ0¶шмШ±дґуУЪ0µД·ґУ¦їП¶ЁКЗЧФ·ўµД
C. ТтОЄмК±дєНмШ±д¶јУл·ґУ¦µДЧФ·ўРФУР№ШЈ¬ТтґЛмК±д»тмШ±дѕщїЙТФµҐ¶АЧчОЄ·ґУ¦ЧФ·ўРФµДЕРѕЭ
D. ФЪЖдЛыНвЅзМхјюІ»±дµДЗйїцПВЈ¬К№УГґЯ»ЇјБїЙТФёД±д»ЇС§·ґУ¦ЅшРРµД·ЅПт
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїУР№Шѕ§МеµДПВБРЛµ·ЁЦРЈ¬ХэИ·µДКЗ( )
AЈ®·ЦЧУѕ§МеЦР·ЦЧУјдЧчУГБ¦ФЅґуЈ¬·ЦЧУФЅОИ¶Ё
BЈ®¶юСх»Ї№иµДИЫµгЎўУІ¶Иѕщ±И¶юСх»ЇМјёЯ
CЈ®±щИЪ»ЇК±Л®·ЦЧУК±Ј¬Ѕц№ІјЫјь·ўЙъ¶ПБСЈ¬·ЦЧУ±ѕЙнГ»УР±д»Ї
DЈ®ВИ»ЇДЖИЫ»ЇК±АлЧУјь±»ЖЖ»µЈ¬№ККфУЪ»ЇС§±д»Ї
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїПЦУРИзПВБЅёцЧ°ЦГЈ¬ЖдЦРРїЖ¬єННЖ¬ѕщОЄЧгБїЈ¬Зл»ШґрПа№ШОКМвЎЈ

ЈЁ1Ј©Ч°ЦГТТЦРїЙ№ЫІмµЅµДПЦПуКЗ_______ЎЈ
ЈЁ2Ј©ИфјЧЦРЛщУГБтЛбОЄ80%µДЕЁБтЛбЈ¬їЄКјЅЧ¶ОїЙ№ЫІмµЅµДПЦПуКЗ_____Ј¬Рїµзј«ЙП·ўЙъµД·ґУ¦АаРНКЗ_____ЈЁМоЎ°Сх»Ї·ґУ¦Ў±»тЎ°»№Ф·ґУ¦Ў±Ј©Ј¬ґЛК±µДЧЬ·ґУі»ЇС§·ЅіМКЅОЄ_______ЎЈТ»¶ОК±јдєуЧ°ЦГЦР·ўЙъБЛБнТ»ёц·ґУ¦Ј¬ФТтКЗ_______Ј¬УлїЄКјЅЧ¶ОПа±ИРїЖ¬ЙПµД·ґУ¦КЗ·с·ўЙъБЛ±д»Ї______ЈЁМоЎ°КЗЎ±»тЎ°·сЎ±Ј©
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎї·ЦЧУКЅОЄC5H11Cl µДН¬·ЦТм№№Ме№ІУР(І»їјВЗБўМеТм№№) ( )
AЈ®6ЦЦ BЈ®7ЦЦ CЈ®8ЦЦ DЈ®9ЦЦ
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїWЎўXЎўYЎўZЎўNЎўMБщЦЦЦчЧеФЄЛШЈ¬ЛьГЗФЪЦЬЖЪ±нЦРО»ЦГИзНјЛщКѕЈ¬ПВБРЛµ·ЁІ»ХэИ·µДКЗ

A. ФЧУ°лѕ¶ЈєYЈѕZЈѕW
B. µҐЦКµД»№ФРФЈєXЈѕY
C. деУлФЄЛШMН¬ЦчЧеЈ¬ЧоёЯјЫСх»ЇОпµДЛ®»ЇОпµДЛбРФ±ИMµДЗї
D. ФЄЛШNО»УЪЅрКфУл·ЗЅрКфµД·ЦЅзПЯёЅЅьЈ¬їЙТФНЖ¶ПNФЄЛШµДµҐЦКїЙЧч°лµјМеІДБП
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎї°ґХХОЮ»ъОпµД·ЦАа·Ѕ·ЁЈ¬ПВБРёчЧйОпЦКЦРЈ¬КфУЪІ»Н¬АаРНµДОпЦККЗ
AЈ®ґїјоЎўЙХјоЎўЙъКЇ»Т BЈ®ЙъКЇ»ТЎў±щЎўёЙ±щ
CЈ®КмКЇ»ТЎўїБРФДЖЎўЗвСх»ЇјШ DЈ®ґїјоЎўБтЛбДЖЎўµЁ·Ї
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїТСЦЄ¶МЦЬЖЪФЄЛШµДАлЧУaA2+ЎўbB+ЎўcC3©ЃЎўdD©Ѓ¶јѕЯУРПаН¬µДµзЧУІгЅб№№Ј¬ФтПВБРРрКцХэИ·µДКЗЈЁ Ј©
A. ФЧУ°лѕ¶ AЈѕBЈѕDЈѕC B. ФЧУРтКэ dЈѕcЈѕbЈѕa
C. АлЧУ°лѕ¶ CЈѕDЈѕBЈѕA D. µҐЦКµД»№ФРФ AЈѕBЈѕDЈѕC
Ійїґґр°ёєНЅвОц>>
°Щ¶ИЦВРЕ - Б·П°ІбБР±н - КФМвБР±н
єю±±КЎ»ҐБЄНшОҐ·ЁєНІ»БјРЕПўѕЩ±ЁЖЅМЁ | НшЙПУРє¦РЕПўѕЩ±ЁЧЁЗш | µзРЕХ©ЖѕЩ±ЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРє¦РЕПўѕЩ±ЁЧЁЗш | ЙжЖуЗЦИЁѕЩ±ЁЧЁЗш
ОҐ·ЁєНІ»БјРЕПўѕЩ±Ёµз»°Јє027-86699610 ѕЩ±ЁУКПдЈє58377363@163.com