
将22.4g铜和氧化铁的混合物粉末加入到浓度为1mol/L的硫酸中,固体恰好完全溶解,滴入KSCN溶液不显色,此时消耗硫酸体积为VL。
(1)硫酸体积V的 L。
(2)将所得溶液释释到1L,求此时溶液中金属阳离子物质的量浓度?
 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源:物理教研室 题型:038
常温下,反应
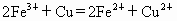 在水溶液中能发生,将22.4g铜和三氧化二铁的混合粉末加入到浓度为1mol/L的硫酸中,使之发生反应.
在水溶液中能发生,将22.4g铜和三氧化二铁的混合粉末加入到浓度为1mol/L的硫酸中,使之发生反应.
(1)若固体恰好全部溶解,消耗硫酸的体积为VL,求V的取值范围.
(2)若硫酸溶液过量,反应后溶液的体积为1L,测得此溶液中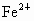 的浓度为0.1mol/L,求原混合物中含铜多少克?
的浓度为0.1mol/L,求原混合物中含铜多少克?
查看答案和解析>>
科目:高中化学 来源: 题型:058
常温下,反应
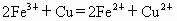 在水溶液中能发生,将22.4g铜和三氧化二铁的混合粉末加入到浓度为1mol/L的硫酸中,使之发生反应.
在水溶液中能发生,将22.4g铜和三氧化二铁的混合粉末加入到浓度为1mol/L的硫酸中,使之发生反应.
(1)若固体恰好全部溶解,消耗硫酸的体积为VL,求V的取值范围.
(2)若硫酸溶液过量,反应后溶液的体积为1L,测得此溶液中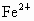 的浓度为0.1mol/L,求原混合物中含铜多少克?
的浓度为0.1mol/L,求原混合物中含铜多少克?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com