
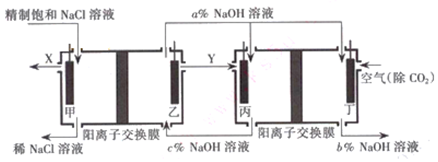
分析 (1)阳离子交换膜只允许阳离子通过,而阴离子不能通过;
(2)除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,盐酸要放在最后,来除去过量的氢氧化钠和碳酸钠,要先加过量的氯化钡除去硫酸根离子,然后用碳酸钠去除过量的钡离子;
(3)①由于在燃料电池中氧气在正极放电,可燃性气体在负极放电,所以通入空气的极是正极,则通入可燃性气体Y的极是负极,根据在氯碱工业中,电解食盐水除了生成NaOH还生成氯气和氢气,和空气形成燃料电池的为氢气,即Y是氢气,则X是氯气;
燃料电池中的离子膜只允许阳离子通过,而燃料电池中正极氧气得到电子产生OH-,所以反应后氢氧化钠的浓度升高,即a%小于c%,可知NaOH浓度增大;
②燃料电池中负极氢气失电子发生氧化反应;
③根据燃料电池能将化学能转化为电能结合该方法来分析其优点之处.
解答 解:(1)阳离子交换膜只允许阳离子H+和Na+通过,而阴离子氢氧根和氯离子均不能通过,故答案为:H+和Na+;
(2)要先除硫酸根离子,然后再除钙离子,碳酸钠可以除去过量的钡离子,如果加反了,过量的钡离子就没法除去,至于加氢氧化钠除去镁离子顺序不受限制,因为过量的氢氧化钠加盐酸就可以调节了,只要将三种离子除完了,过滤就行了,最后加盐酸除去过量的氢氧根离子碳酸根离子,故选:B;
(3)①由于在燃料电池中氧气在正极放电,可燃性气体在负极放电,所以通入空气的极是正极,则通入可燃性气体Y的极是负极,根据在氯碱工业中,电解食盐水除了生成NaOH还生成氯气和氢气,和空气形成燃料电池的为氢气,即Y是氢气,则X是氯气;
燃料电池中的离子膜只允许阳离子通过,而燃料电池中正极氧气得到电子产生OH-,所以反应后氢氧化钠的浓度升高,即a%大于b%,负极氢气失电子生成氢离子消耗氢氧根离子,所以c%>a%,得到c%>a%>b%,故答案为:c>a>b,
故答案为:氯气;c>a>b;
②燃料电池中负极氢气失电子发生氧化反应,电极反应式为2H2+4OH--4e-=4H2O,故答案为:2H2+4OH--4e-=4H2O;
③据装置特点及反应过程可知,这样设计的优点是燃料电池可以补充电解池消耗的电能;提高产出碱液的浓度;降低能耗等,
故答案为:燃料电池可以补充电解池消耗的电能、提高产出碱液的浓度.
点评 本题考查了电解原理,为高频考点,侧重于学生的分析能力和计算能力的考查,明确离子交换膜的作用及阴阳极上发生的反应是解本题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
| K1 | K2 | |
| H2SO3 | 1.54×10-2 | 1.02×10-7 |
| H2CO3 | 4.3×10-7 | 5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气通入醋酸溶液CH3COOH+NH3═CH3COONH4 | |
| B. | 澄清的石灰水跟盐酸反应H++OH-═H2O | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+═Cu2++Ag | |
| D. | 碳酸钙跟盐酸反应CaCO3+2HCl═2Ca++H2CO3↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫可广泛用于食品的增白 | |
| B. | 用硫酸清洗锅垢中的水垢 | |
| C. | 用SO2漂白纸浆和草帽辫 | |
| D. | 因为浓硫酸有强氧化性,故浓硫酸可用于干燥H2和CO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.4Q1+0.05Q3 | B. | 0.4Q1+0.05Q2 | C. | 0.4Q1+0.1Q3 | D. | 0.4Q1+0.2Q2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com