
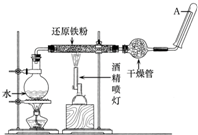
 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应.应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气反应的实验”.
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应.应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气反应的实验”.分析 (1)Fe与水蒸气可发生反应生成四氧化三铁和氢气;
(2)该反应有气体参加和生成,装置不能漏气,且氢气不纯加热可能发生爆炸;
(3)由图可知,加热圆底烧瓶,提供水蒸气;
(4)A试管中收集到可燃性气体氢气,氢气不纯加热可能发生爆炸.
解答 解:(1)该反应的化学方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;
(2)实验前必须对整套装置进行的操作是检验装置的气密性,故答案为:检验装置的气密性;
(3)圆底烧瓶中盛装的是水,该装置受热后的主要作用是为(硬质玻璃管内Fe与水蒸气的反应)实验提供(持续不断的)水蒸气,
故答案为:为(硬质玻璃管内Fe与水蒸气的反应)实验提供(持续不断的)水蒸气;
(4)试管中收集到的气体是H2,如果要在A处玻璃管口处点燃该气体,则必须对该气体进行验纯,故答案为:H2;验纯.
点评 本题考查物质的性质实验,为高频考点,把握物质的性质、发生的反应及实验技能等为解答的关键,侧重分析与实验能力的考查,注意氢气的性质,题目难度不大.


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 物质的性质 | 实际应用 |
| A | 二氧化锰具有强氧化性 | 用作H2O2分解的氧化剂 |
| B | 液氨汽化时要吸收大量的热 | 用作制冷剂 |
| C | Al2O3熔点高 | 用作耐高温材料 |
| D | 肥皂水显碱性 | 用作蚊虫叮咬处的清洗剂 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
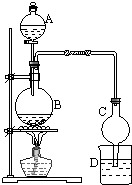 (1)某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中盛有浓硫酸,B中盛有乙醇、乙酸,D中盛有饱和碳酸钠溶液.
(1)某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中盛有浓硫酸,B中盛有乙醇、乙酸,D中盛有饱和碳酸钠溶液.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
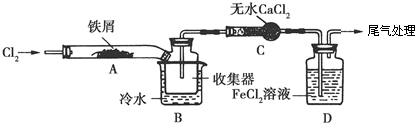
 .FeCl3是共价化合物(填“离子”或“共价”).
.FeCl3是共价化合物(填“离子”或“共价”).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 实验内容 | 实验现象 | 离子方程式 | 实验结论 |
| ① | 在FeCl2溶液中滴入适量氯水 | 溶液由浅绿色变为黄色 | 2Fe2++Cl2=2Fe3++2Cl- | Fe2+具有还原性 |
| ② | 在FeCl3溶液中加入足量铁粉 | 溶液由黄色变为浅绿色 | Fe+2Fe3+=3Fe2+ | Fe3+具有氧化性 |
| ③ | 在FeCl3溶液中滴入适量KI溶液和淀粉溶液 | 溶液最终变为蓝色 | 2Fe3++2I-═2Fe2++I2 | Fe3+具有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
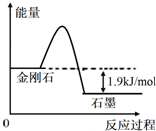 根据表中的信息判断下列说法错误的是( )
根据表中的信息判断下列说法错误的是( )| 物质 | 总键能/(kJ•mol-1) | 燃烧热/(kJ•mol-1) |
| 金刚石 | a | 395.4 |
| 石墨 | b | 393.5 |
| A. | 由表中信息可得如右图所示的图象 | |
| B. | 由表中信息知C(石墨,s)=C(金刚石,s)△H=+1.9kJ/mol | |
| C. | 由表中信息可推知a<b | |
| D. | 表示石墨燃烧热的热化学方程式为C(石墨,s)+1/2O2(g)═CO(g)△H=-393.5kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用10 mL量筒量取7.13 mL盐酸 | |
| B. | 用广泛pH试纸测得某溶液的pH为2.3 | |
| C. | 用25ml酸式滴定管量取21.70 mLKMnO4溶液 | |
| D. | 用托盘天平称量25.20 g NaCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com