
现有部分短周期元素的性质或原子结构如下表:
| 元素编号 | 元素性质或原子结构 |
| A | 有三个电子层,K、M层电子数之和等于L层电子数 |
| B | 短周期中金属性最强 |
| C | 常温下单质为双原子分子,氢化物的水溶液呈碱性 |
| D | 元素最高正价是+7价 |
(1)用化学用语回答下列问题:
①A元素在周期表中的位置 ;
②B元素原子结构示意图 ;
③C单质分子的电子式 ;用电子式表示A和B元素组成的化合物的形成过程 ;
④D元素在自然界有两种核素,用原子符号表示其中子数为20的核素 。
(2)元素D与元素A相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是 (填选项序号)。
a.常温下D的单质和A的单质状态不同
b.D的氢化物比A的氢化物稳定
c.一定条件下D和A的单质都能与钠反应
d.A的最高价含氧酸酸性弱于D的最高价含氧酸
e.D单质能与A的氢化物反应生成A单质
(3)探寻物质的性质差异性是学习的重要方法之一。A、B、C、D四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种的是 (写化学式)。
(4)X是由A、B、C、D四种元素中的某种元素组成的单质,能经下图所示的过程转化为W(其他条件略去)。
![]()
①若Y是有刺激性气味的无色气体,把Y通入BaCl2溶液中,然后滴加适量H2O2溶液,有白色沉淀生成,此白色沉淀的化学式为: ;生成该白色沉淀的化学方程式为 ;
②若Z是红棕色气体,则Z→W的反应中氧化剂与还原剂物质的量之比为: 。
(1)①三周期ⅥA族 ..........................................................(1分)
② ![]() ...........................................................(1分)
...........................................................(1分)
③ ![]() ............................................................(1分)
............................................................(1分)
![]() ….(2分)
….(2分)
④![]() ............................................................................(1分)
............................................................................(1分)
(2)Cl ...........................................................................(1分)
bde ...........................................................................(2分)
(3)NaOH ..........................................................................(1分)
(4)①BaSO4..........................................................................(1分)
BaCl2+SO2+H2O2=BaSO4↓+2HCl(或Ba2+ +SO2 +H2O2 = BaSO4↓+2H+)....(2分)
②1:2 ..........................................................................(2分)


科目:高中化学 来源: 题型:
| 元素编号 | 元素性质或原子结构 |
| T | K层和M层上电子数之和等于L层上电数子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | 元素性质或原子结构 |
| A | 该元素的一种原子,原子核中没有中子 |
| B | 有三个电子层,且K、M层电子数之和等于L层电子数 |
| C | 单质为双原子分子,其氢化物的水溶液呈碱性 |
| D | 元素最高正价是+7价 |
| E | 1mol E的单质与足量的稀盐酸反应,可得到氢气33.6L (标准状况) |



查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | 元素性质或原子结构 |
| X | 最外层电子数是次外层电子数的3倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 第三周期元素的简单离子中半径最小 |
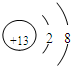
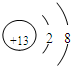
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 元素编号 | 元素性质或原子结构 |
| A | 有三个电子层,K、M层电子数之和等于L层电子数 |
| B | 短周期中金属性最强 |
| C | 常温下单质为双原子分子,氢化物的水溶液呈碱性 |
| D | 元素最高正价是+7价 |






| O2 |
| O2 |
| H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | 元素性质或原子结构 |
| T | 单质能与水剧烈反应,所得溶液呈弱酸性 |
| X | L层p电子数比s电子数多2个 |
| Y | 第三周期元素的简单离子中半径最小 |
| Z | L层有三个未成对电子 |




 Al(OH)3
Al(OH)3 Al3++3OH-
Al3++3OH- Al(OH)3
Al(OH)3 Al3++3OH-
Al3++3OH-查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com